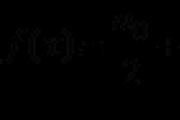Njegov demo kemije. Trivality ЄDI z chemії
14. novembra 2016 je bila odobrena različica objavljena na spletni strani FIPD možnosti demonstracije, kodifikator in specifičnost kontrolnih materialov enotne državne raziskave in glavne državne raziskave v letu 2017, vključno s kemijo.
Demo različica ЄDI z khimiї 2017
| Možnost zavdan + vіdpovіdі | Pridobite demo različico |
| Specifikacija | demo varianta himiya ege |
| Kodifikator | kodifikator |
Demo različica EDI z chemistry 2016-2015
| Kemija | Pridobite demo različico + ocene |
| 2016 | ege 2016 |
| 2015 | ege 2015 |
Na KIM z khimiї u 2017 roci suttєvі chіnі, zato je bila demo različica preteklih usod prinesena za pojasnitev.
Kemija - bistvo spremembe: Optimizirana je bila struktura izpitnega dela:
1. Struktura 1. dela KIM je bila bistveno spremenjena: naloga je bila izključena z izbiro enega kandidata; naloga združevanja za okremi tematske bloke, za skin s takih ê naloga osnovnega, napredna stopnja zlaganja pa.
2. Spremenjeno skupno število delovnih mest iz 40 (2016) na 34.
3. Lestvica ocenjevanja (od 1 do 2 točki) je bila spremenjena v vodjo osnovne stopnje zlaganja, z namenom ponovnega pretehtanja pridobljenega znanja o genetski povezavi anorganskih in organskih govorov (9. in 17.).
4. Najvišja prva ocena za zmagovito robotiko je 60 točk (zamenjanih 64 točk za leto 2016).
Trivality ЄDI z chemії
Skupno trajanje izpitnega obdobja je 3,5 leta (210 minut).
Približna ura, ko se začne vikonanny okremikh zavdan, da postane:
1) za nastavitev kože osnovnega nivoja zlaganja dela 1-2-3 peresa;
2) za nego kože promovirali enakopravne zložljivi deli 1-5-7 peres;
3) za nego kože visoke stopnje zlaganja, del 2-10-15 peres.
Specifikacija
kontrolni materiali
za rotacijo Združenih držav Spitu leta 2017
s KEMIJA
1. Imenovanje KIM EDI
Edina državna izkušnja (v nadaljevanju - ЄДІ) je oblika objektivne ocene kakovosti usposabljanja študentov, saj so obvladali izobraževalne programe srednjega razreda. globalno izobraževanje, Iz izbora standardiziranega obrazca (kontrolni materiali).
ЄДІ se izvaja v skladu z zveznim zakonom z dne 29. decembra 2012 št. 273-ФЗ "O izobraževanju v Ruski federaciji".
Kontrolni materiali omogočajo ugotavljanje stopnje obvladovanja diplomantov zvezne komponente državnega standarda srednjega (novega) globalnega izobraževanja kemije, osnovne in profilne ravni.
Rezultate enotne suverene raziskave v kemiji priznavajo svetilne organizacije srednjega strokovno izobraževanje in izobraževalne organizacije višjega strokovnega izobraževanja kot rezultat sprejemnih izpitov iz kemije.
2. Dokumenti, ki jih izda KIM EDI
3. Pridite do izbire zamenjave, analize strukture KIM EDI
Osnova vložkov pred distribucijo KIM EDI 2017 z khіmії zložene zagalnі metodične instalacije, yakі so bili imenovani v procesu oblikovanja izpitni modeli prejšnje kamnine. Bistvo teh instalacij je os y.
- KІМ je usmerjen v ponovno preverjanje pridobljenega sistema znanja, ki velja za invariantno jedro istih razvojnih programov kemije za globalne svetilne organizacije. V standardu je sistem znanja predstavljen kot pomoč pri pripravi diplomantov. Zimi vymogami spіvvіdnositsya rіvennja prіvlennya v KІM elementi vmіstu, scho verіryayutsya.
- Da bi zagotovili možnost diferencialne ocene začetnih dosežkov diplomantov KIM ЄDI, zdіysnyuyut ponovno preverjanje obvladovanja glavnih izobraževalnih programov iz kemije na treh ravneh zahtevnosti: osnovni, napredni in visoki. Začetni material, katerega temelji bo naloga, so izbrani po znaku njenega pomena za globalno izobraževanje maturantov v srednji šoli.
- Vikonannya zavdan ekzamenatsiynoi roboti prenos zdiisnennya petje sukupnosti diy. Med njimi so najbolj razmetljive na primer takšne: pokazati klasifikatorju znake govora in reakcij; izberite oksidacijsko stanje kemični elementi za formulami njihovih polkolkov; razložiti bistvo tega chi іnshoy procesa, vzaєmozv'yazku skladišče, biti ta moč govorov. Vmіnnya izmenovavannogo zdіysnyuvaty raznomanіtnі dії in vykonanny roboti se obravnava kot prikaz obvladovanja zvitega materiala s potrebno globino razumevanja.
- Enakovrednost vseh variant izpitnega dela je zagotovljena z uvedbo enake stopnje usposobljenosti naloge, ki se ponovno preuči s pridobivanjem glavnih elementov ključnih oddelkov predmeta kemija.
4. Struktura KIM EDI
Kožna različica izpitnega dela napotkov za en sam načrt: delo je sestavljeno iz dveh delov, ki vključuje 40 nalog. 1. del 35. dneva kratkega odmora, sredi njih 26. dan osnovne stopnje zlaganja (zaporedne številke reda: 1, 2, 3, 4, ... 26) in 9. dan napredna stopnja zlaganja (vrstni red dneva naročila: 27, 28, 29, …35).
2. del za maščevanje 5. dne visoke stopnje zlaganja z odprtim ognjem (zaporedne številke teh ukazov: 36, 37, 38, 39, 40).
Vrste testnih nalog iz kemije so lahko 10 možnosti za sklope nalog, zloženih za izboljšanje lastnosti in moči enega samega suverenega spanja v letu 2017. Namen pomoči je bralcem podati informacije o strukturi študija kemije KIM 2017, stopnji zahtevnosti naloge.
Vzorčevalec je dobil mnenje o vseh testnih možnostih in sprejelo odločitev o vseh nalogah ene od možnosti. Poleg tega so bili narisani znaki praznin, kot da bi zmagali na ЄDI, da bi zabeležili mnenja o tej odločitvi.
Avtor je vodilni znanstvenik, referent in metodolog, ki neprekinjeno sodeluje pri razvoju kontrolnih vimiruvalnih materialov EDI.
Pomočnik pri imenovanjih za učitelje za pripravo študentov na študij kemije, pa tudi za dijake in maturante - za samoizobraževanje in samokontrolo.
uporabite.
Amonijev klorid ima kemične vezi:
1) ionnі
2) kovalentna polarna
3) kovalentni nepolarni
4) voda
5) kovina
Iz propioniranega prevoda govorov zavijte dva govora, pri čemer koža reagira z nekaj reakcijami.
1) cinkov klorid (raztopina)
2) natrijev sulfat (raztopina)
3) razredčena dušikova kislina
4) koncentrirana žveplova kislina
5) aluminijev oksid
ZMIST
Peredmova
Navodila za vikonannya roboti
MOŽNOST 1
1. del
2. del
MOŽNOST 2
1. del
2. del
MOŽNOST 3
1. del
2. del
MOŽNOST 4
1. del
2. del
MOŽNOST 5
1. del
2. del
MOŽNOST 6
1. del
2. del
MOŽNOST 7
1. del
2. del
MOŽNOST 8
1. del
2. del
MOŽNOST 9
1. del
2. del
MOŽNOST 10
1. del
2. del
POGLEDAJTE TO RAZLIKO
Vіdpovіdі do vodje dela 1
Odločba in rok za 2. del
Razvyazannya različica naloge 10
1. del
2. del.
Brezplačno zavantazhiti e-knjiga v ročnem formatu se čudite in preberite:
Prenesite knjigo ЄДІ 2017, Kemija, Tipične testne naloge, Medvedev Yu.M. - fileskachat.com, brezplačni prenosi.
- ЄDI 2020, Kemija, Tipične možnosti za izpitna vprašanja pri prodajalcih ЄDI, Medvedev Yu.M., 2020
- ЄDI 2019, Kemija, strokovnjak pri ЄDI, Medvedev Yu.M., Antoshin A.E., Ryabov M.A.
- ODE 2019, Kemija. 32 možnosti, Tipski testi za distribucijo ODE, Molčanova G.M., Medvedev Yu.M., Korošenko O.S., 2019
- Kemija, edini suvereni preizkus, Priprava na atestiranje pod-vreče, Kaverina A.A., Medvedev Yu.M., Molčanova G.M., Sviridenkova N.V., Snastina M.G., Stakhanova S.V., 2019
Za vikonannya zavdan 1-3 vikoristovyte naslednjo vrstico kemičnih elementov. Vіdpovіddu v zavdannya 1–3 є zaporedje števk, pod katerim so kemični elementi navedeni v ta vrstica.
1) Na 2) K 3) Si 4) Mg 5) C
Upravitelj št. 1
Pomembno je, da so atomi nekaterih pomenov številnih elementov lahko na zunanji strani energija enaka chotiri elektronika.
Predlog: 3; 5
Število elektronike na isti energijski ravni (elektronska kroglica) elementov glavnih podskupin je enako številu skupine.
V takem rangu sta silicij in premog primerna za predložitev možnosti za vіdpovіdey, ker smradi odkupujejo iz glavne podskupine četrte skupine tabele D.I. Mendeliev (skupina ІVA), tobto. virni vіdpovіdі 3 in 5.
Upravitelj št. 2
Med imenovanjem za številne kemične elemente izberite tri elemente, kot v Periodnem sistemu kemičnih elementov D.I. Mendeliev rebuy v enem obdobju. Shranite izbrane elemente v vrstnem redu rasti njihovih kovinskih moči.
V polje vpišite številke izbranih elementov v zahtevanem zaporedju.
Predlog: 3; 4; eno
Obstajajo tri predstavitve elementov v enem obdobju - natrij Na, silicij Si in magnezij Mg.
V Rusiji na mejah obdobja periodnega sistema D.I. Mendeliev (vodoravne vrstice) desničar na levo, je lažje dati elektroniko, ki jih širi na zunanjo žogo, tobto. ojača se kovinska moč elementov. Na ta način se v seriji Si okrepi kovinska prevlada natrija, silicija in magnezija. Upravitelj št. 3 3-nadomestne vrednosti v številnih elementih, izberite dva elementa, saj razkrivata nižje oksidacijsko stanje, enako -4. V polje zapišite številke izbranih elementov. Predlog: 3; 5 Praviloma je treba oktet, atome kemičnih elementov, matirati z lastnimi enakimi elektroni elektronske ravni 8, kot v žlahtnih plinih. Kaj je mogoče doseči z oddajo preostalih elektronov, enakih prednjemu, ki lahko maščuje 8 elektronov, ali z dodajanjem dodatnih elektronov do osem. Natrij in kalij se dvigneta v lužaste kovine in ju najdemo v glavni podskupini prve skupine (IA). Tse pomeni, da ima ista elektronska kroglica po en elektron. Na povezavi s cym energijsko vygіdnіshoy є vtrata enega elektrona, nižje od dodatka še sedem. Pri magneziju je podobno, le vina so v glavni podskupini druge skupine, tako da sta na glavnem elektronskem nivoju dva elektrona. Treba je opozoriti, da so natrij, kalij in magnezij postavljeni pred kovine, kovine pa načeloma ne morejo imeti negativne stopnje oksidacije. Najmanjša stopnja oksidacije katere koli kovine je enaka nič in jo opazimo v preprostih govorih. Kemični elementi premoga C in silicija Si je nekovine in so v glavni podskupini četrte skupine (IVA). Tse pomeni, da so na njihovi najbolj oddaljeni elektronski kroglici 4 elektroni. Zato je za te elemente možno dobaviti to elektroniko, tako da je mogoče k veliki številki dodati več, ki je dražja 8 mi. Več kot 4 elektrone na atome silicija in ogljika je nemogoče, zato je najmanjša stopnja oksidacije -4. Upravitelj št. 4 Iz predlagane mešanice izberite dva semestra, v katerih je ionska kemična povezava. Predlog: 1; 3 Prisotnost vezi ionskega tipa v spojini na najpomembnejši način lahko pripišemo dejstvu, da atomi tipične kovine in atom nekovine hkrati vstopajo v eno od strukturnih enot. V ta namen bomo ugotovili, da je ionska vez v isti pod številko 1 - Ca (ClO 2) 2, tk. v tej formuli je možno dobaviti atome tipične kovine kalcija in atome nekovin - kisle in klora. Vendar pa ni več možnosti, da bi se maščevali atomom kovine in nekovine na določenem seznamu. Znakov o prisotnosti ionske vezi je v preteklosti več, lahko rečemo, da je v skladišču ene strukturne enote amonijev kation (NH 4 +) ali drugi organski analogi - alkilamonijev kation RNH 3 +, dialkilamonijev R 2 NH 3 N + i tetraalkilamonijev R 4 N + , de R - deaky ogljikov hidratni radikal. Na primer, ionsko vrsto vezi lahko najdemo v stičišču (CH 3) 4 NCl med kationom (CH 3) 4 + in kloridnim ionom Cl - . Sredina imen v obratu je amonijev klorid, v drugem pa se ionska vez realizira med amonijevim kationom NH 4 + in kloridnim ionom Cl − . Upravitelj št. 5 Nastavite položaj med formulo govora in razredom/skupino, da se uleže na vrsto (-oї) govora: na položaj kože, označen s črko, izberite položaj iz drugega položaja, označenega s številko. V polje zapišite številke izbranega dne. Pričevanje: A-4; B-1; 3 Pojasnilo: Kislinske soli se imenujejo soli, ki so se pojavile kot posledica nepopolne zamenjave rukhomi atomov v vodi s kovinskim kationom, amonijevim kationom ali alkilamonijevim. V anorganskih kislinah, ki prehajajo v okvir šolskega programa, so vsi atomi in voda gnili, tako da jih lahko nadomesti kovina. Ostanki soli anorganskih kislin medija, predstavljenega na seznamu, so amonijev bikarbonat NH 4 HCO 3 - produkt zamenjave enega od dveh atomov vode v ogljikovi kislini za amonijev kation. Dejansko je kislost srednja med normalno (povprečno) kislostjo. V primeru NH 4 HCO 3 - medij med normalnim pragom (NH 4) 2 CO 3 in ogljikovo kislino H 2 CO 3. V organskih govorih se na atome kovine nadomestijo le atomi in voda, ki vstopijo v skladišče karboksilnih skupin (-OOH) ali hidroksilnih skupin fenolov (Ar-OH). Tobto, na primer, natrijev acetat CH 3 COONa, ne glede na tiste, ki v tej molekuli niso vsi atomi in voda substitucija na kovinskih kationih, medij, in ne kisla kislina (!). Atomsko vodo v organskih govorih, vezano brez sredine na atom ogljika, je praktično nemogoče nadomestiti z atomom kovine, za atomsko vodo v vodi s trojno povezavo C-W. Oksidi, ki ne tvorijo soli - oksidi nekovin, ki se utvorijo z bazičnimi oksidi in bazami soli, zato bodisi ne reagirajo z njo (najpogosteje) ali pa ima reakcija z njo drug produkt (ne močan ). Pogosto se zdi, da so neslani oksidi nekovinski oksidi, ki ne reagirajo z bazami in bazičnimi oksidi. Prote, manifestacija oksidov, ki ne tvorijo soli, je taka pidhid spratsovuє zavzhd. Tako, na primer, CO, kot neslan oksid, reagira z glavnim oksidom fiziološke raztopine (II), vendar z raztopinami ne soli, ampak proste kovine: CO + FeO = CO 2 + Fe K neslanim oksidom v srednješolskem tečaju kemije so vključeni nekovinski oksidi na stopnji oksidacije +1 in +2. Njihov Usy je sustrichaetsya v ЄDI 4 - tse CO, NO, N 2 O in SiO (preostali SiO ni posebej sustrichavsya v zavdannya). Upravitelj št. 6 Iz propioniranega prevoda govorov zavijte dva govora, iz kože, ki dobro reagirata brez segrevanja. Predlog: 2; 4 Cinkov klorid se doda soli, cinkov klorid pa kovinam. Kovina le v tem primeru reagira iz neumnosti, saj je hkrati bolj aktivna, ki vstopi v skladišče soli. Pomembna aktivnost kovin je posledica nizke aktivnosti kovin (z drugimi besedami, niz kovinskih napetosti). Zalizo v seriji aktivnosti kovin je bolj primeren za cink, vendar je manj aktiven in ni več verjetno, da bo cink odstranil iz soli. Zato reakcija dvorane iz govora št. 1 ne gre. Sulfat midi (II) CuSO 4 bo reagiral s fiziološko raztopino, saj je slina v nizu aktivnosti navedena kot midi, zato je bolj aktivna kovina. Koncentrirana dušikova kislina, kot tudi koncentrirana žveplova kislina, ne deluje brez segrevanja, reagira s toploto, aluminijem in kromom pri pojavu takega pojava, kot je pasivacija: na površini teh kovin je mogoče vzpostaviti vlogo brez segrevanja sile Ko se segreje, se lupina razširi in reakcija postane možna. Tobto. drobci so dodeljeni, ne morem segreti, reakcija dvorane s konc. HNO 3 ne pušča. Klorovodikovo kislino lahko dodajamo neoksidativnim kislinam ne glede na koncentracijo. Reagirali so z neoksidacijskimi kislinami z vodo, kar bi moralo biti poleg aktivnosti vode. Te kovine so blizu. Visnovok: reakcija zalivanja z uhajanjem klorovodikove kisline. V času kovine in kovinskega oksida je reakcija, kot in v depresiji iz neumnosti, možna, saj je kovina bolj aktivna za tiste, ki vstopijo v skladišče oksidov. Fe, blizu aktivnosti kovin, manj aktiven, nižji Al. Tse pomeni, da Fe s Al 2 O 3 ne reagira. Upravitelj št. 7 Iz proponirane perelike se vzameta dva oksida, saj reagirata z različno klorovodikovo kislino, ale ne reagiraj
iz različnega natrijevega hidroksida. V polje zapišite številke izbranih govorov. Predlog: 3; 4 CO je neslan oksid, ne reagira z vodnimi travniki. (Po spominu, sho, ne manj, v zhorstnih glavah - visok tlak in temperatura - vino še vedno reagira s trdim travnikom, postavlja oblike - soli mravljinčne kisline.) SO 3 - žveplov oksid (VI) - kisli oksid, ki je podoben žveplovi kislini. Kisli oksidi ne reagirajo s kislinami in drugimi kislinskimi oksidi. Torej SO 3 ne reagira s klorovodikovo kislino in reagira z bazo - natrijevim hidroksidom. Ne pojdi. CuO - midi (II) oksid - lahko pripeljemo do oksidov z glavno močjo. Reagira s HCl in ne reagira z natrijevim hidroksidom. pridi MgO - magnezijev oksid - lahko privedemo do tipičnih bazičnih oksidov. Reagira s HCl in ne reagira z natrijevim hidroksidom. pridi ZnO - oksid z jasno izraženo amfoterno močjo - zlahka reagira tako z močnimi bazami kot s kislinami (pa tudi s kislimi in bazičnimi oksidi). Ne pojdi. Upravitelj št. 8 Predlog: 4; 2 V reakciji med dvema solma anorganskih kislin je manj verjetno, da se bo plin raztopil, če se po raztapljanju toplotno nestabilnega amonijevega nitrita mešajo vroči nitriti in amonijeve soli. na primer NH 4 Cl + KNO 2 \u003d t o \u003d\u003e N 2 + 2H 2 O + KCl Vendar seznam ne vključuje nitritov in amonijevih soli. Prav tako ena od treh soli (Cu(NO 3) 2 , K 2 SO 3 in Na 2 SiO 3 ) reagira bodisi s kislino (HCl) bodisi s travnikom (NaOH). Med solmi anorganskih kislin plin pri interakciji s travniki vidijo le amonijeve soli: NH 4 + + OH \u003d NH 3 + H 2 O Amonijeva sol, kot smo že rekli, ni seznama. Možnosti interakcije soli s kislino ni več. K solim sredine pomena govorov položijo Cu (NO 3) 2, K 2 SO 3 in Na 2 SiO 3. Reakcija midinitrata iz klorovodikove kisline ne poteka, ker ne zadovoljite se s plinom, ne obleganjem ali govorom z nizko disociacijo (svinec ali šibka kislina). Natrijev silikat reagira s klorovodikovo kislino; Na 2 SiO 3 + 2HCl \u003d 2NaCl + H 2 SiO 3 ↓ Preostala možnost je opuščena - interakcija kalijevega sulfita in klorovodikove kisline. Dejansko se kot posledica reakcije ionske izmenjave med sulfitom in praktično katero koli kislino raztopi nežveplova kislina, pravzaprav se razpade na žveplov oksid (IV) podoben plinu brez ječk in vodo. Upravitelj št. 9 Pod ustreznimi črkami vpiši v tabelo številke izbranih govorov. Predlog: 2; 5 CO 2 dovedemo do kislih oksidov in da bi ga spremenili v silo, ga je treba dvigniti bodisi z bazičnim oksidom bodisi z bazo. Tobto. Za odstranitev kalijevega karbonata iz CO 2 je potrebno vanj dodati kalijev oksid ali kalijev hidroksid. V tem vrstnem redu je govor X kalijev oksid: K 2 O + CO 2 \u003d K 2 CO 3 Kalijev bikarbonat KHCO 3, jak in kalijev karbonat, є sіllyu vugіlnoї kisline, tієyu manj razlike, scho bikarbonat є produkt nepopolne zamenjave atomov v vodi iz vugіlnіy kisline. Da bi odstranili normalno (srednjo) sol, kislo jakost, jo je treba ali dvigniti s težko kislino, ki je vzpostavljena jakost, ali jo dvigniti s kislim oksidom, ki to kislino poslabša, v prisotnosti voda. Tako je reagent Y ogljikov dioksid. Ko jogo prenesemo skozi vodno raztopino, ostane kalijev karbonat, da preide v kalijev bikarbonat: K 2 CO 3 + H 2 O + CO 2 \u003d 2KHCO 3 Upravitelj št. 10 Nastavite razliko med reakcijami in močjo elementa na dušik, kot da bi bil v vaši reakciji: na položaj kože, označen s črko, da zavzamete pravilen položaj, označen s številko. Pod ustreznimi črkami vpiši v tabelo številke izbranih govorov. Pričevanje: A-4; B-2; IN 2; G-1 A) NH 4 HCO 3 - moč, v skladišče, ki vključuje amonijev kation NH 4 +. V amonijevem kationu je dušik glavna stopnja oksidacije, ki je -3. Kot rezultat reakcije se vino pretvori v amoniak NH 3 . Voda je praktično zavzhdi (krim yogo spoluk z kovine) maє stopnje oksidacije, kar je dobro +1. Da je bila molekula amoniaka električno nevtralna, je dušik kriv za mati oksidacijske faze, ki je zdrava -3. Otzhe, sprememba stopnje oksidacije v dušik ni mogoča, tobto. vina ne kažejo prevladujoče moči oksidov. B) Kot je prikazano zgoraj, lahko dušik v amoniaku NH 3 oksidiramo na -3. Kot rezultat reakcije s CuO se amoniak pretvori v preprost govor N 2 . V prisotnosti preprostega govora so stopnje oksidacije elementa, kot da bi bile ugotovljene, enake nič. Na ta način dušikov atom izgubi negativni naboj, drobci negativnega naboja pa dajo elektrone, kar pomeni, da ga atom dušika zaradi reakcije izgubi. Element, ki zaradi reakcije izgubi del svojih elektronov, se imenuje vir. C) Zaradi reakcije NH 3 s stopnjo oksidacije v dušik, ki vodi do -3, se pretvori v dušikov oksid NO. Kisen rastlina praktično najvišjo stopnjo oksidacije, kar je dobro -2. Da bi bila molekula dušikovega oksida električno nevtralna, je atom dušika odgovoren za mati oksidacijskega stanja +2. Tse pomeni, da atom dušika po reakciji spremeni svojo oksidacijsko stopnjo iz -3 na +2. O izgubi 5 elektronov zaradi atoma dušika ni vredno govoriti. Tobto dušik, kot in trapleyaetsya B, є vіdnovnikom. D) N 2 - preprost govor. V vseh preprostih govorih ima lahko element, ki jih naredi, oksidacijsko stanje, ki je zdravo 0. Kot rezultat reakcije se dušik pretvori v litijev nitrid Li3N. Posamezna stopnja oksidacije lužičaste kovine, krema nič (stopnjo oksidacije 0 lahko najdemo v katerem koli elementu), dobro +1. Na ta način, da bi bila strukturna enota Li3N električno nevtralna, je dušik odgovoren za mati oksidacijskih stopenj, ki je -3. Pridi ven, kot posledica reakcije je dušik pridobil negativen naboj, kar pomeni prihod elektronov. Dušik v tej reakciji oksidira. Upravitelj št. 11 Če želite določiti položaj med formulo govora in reagenti, s kožo katerega koli od teh govorov je mogoče kombinirati: na položaj kože, označen s črko, zavzeti pravilen položaj, označen s številko. D) ZnBr 2 (raztopina) 1) AgNO 3, Na 3 PO 4, Cl 2 2) BaO, H2O, KOH 3) H2, Cl2, O2 4) HBr, LiOH, CH3COOH 5) H3PO4, BaCl2, CuO Pod ustreznimi črkami vpiši v tabelo številke izbranih govorov. Pričevanje: A-3; B-2; AT 4; G-1 A) Ko plinu podobna voda prehaja skozi taljenje sirke, se vzpostavi krožeča voda H 2 S: H 2 + S \u003d t o \u003d\u003e H 2 S Ko klor prehaja čez nastavljeno žveplo pri sobni temperaturi, se žveplov diklorid raztopi: S + Cl 2 \u003d SCl 2 Za stavbe EDI vedo, kako sirka reagira s klorom in tega ni treba beležiti. Golovnya - na načelni ravni spomina, scho sirka іz klor reagira. Klor je močan oksidant, sirka pogosto kaže osnovno funkcijo - kot oksidant, zato daje energijo. Tobto, kot močno oksidacijsko sredstvo, kot je molekularni klor Cl 2, bo oksidiran. Sirka gorijo modre polsveti v bližini kislega plina z močnim vonjem - žveplov dioksid SO 2: B) SO 3 - žveplov oksid (VI) lahko jasno pokaže moč kisline. Za takšne okside so najbolj značilne reakcije interakcije z vodo, pa tudi z bazičnimi in amfoternimi oksidi in hidroksidi. Seznam pod številko 2 vključuje vodo, bazični oksid BaO in hidroksid KOH. Ko kisli oksid interagira z bazičnim oksidom, se jakost kisle kisline in kovine raztopi, ki vstopi v skladišče bazičnega oksida. Kislemu oksidu se doda ta kislina, v kateri kislinski element ima lahko enako stopnjo oksidacije kot v oksidu. Oksid SO 3 obdelamo z žveplovo kislino H 2 SO 4 (in tam in tam je stopnja oksidacije naprednejša +6). Na ta način bodo pri interakciji SO 3 s kovinskimi oksidi nastale soli žveplove kisline - sulfat, ki bo nadomestil sulfatni ion SO 4 2-: SO 3 + BaO = BaSO 4 Pri interakciji z vodo se kisli oksid pretvori v kislo kislino: SO 3 + H 2 O \u003d H 2 SO 4 In z interakcijo kislih oksidov s kovinskimi hidroksidi, se moč vodne kisle vode raztopi: SO 3 + 2KOH \u003d K 2 SO 4 + H 2 O C) Cinkov hidroksid Zn(OH) 2 ima lahko vrsto amfoterne moči, tako da reagira tako s kislimi oksidi in kislinami kot z bazičnimi natrijevimi oksidi. Seznam vsebuje 4 bachime kot kisline - brom-vodni HBr in otsov ter travnik - LiOH. Uganimo, kateri travniki se imenujejo vodno-hidroksi-kovine: Zn(OH) 2 + 2HBr = ZnBr 2 + 2H2O Zn (OH) 2 + 2CH 3 COOH \u003d Zn (CH 3 COO) 2 + 2H 2 O Zn(OH) 2 + 2LiOH \u003d Li 2 D) Cinkov bromid ZnBr 2 є sillu, rozchinny v vodі. Za maloprodajne soli so najbolj razširjene reakcije ionske izmenjave. Moč lahko reagira z drugo močjo za um, da se žalitve vihіdnі soli razširijo in obleganje se vzpostavi. Prav tako ZnBr 2 zavira bromidni ion Br-. Za kovinske halogenide je značilno, da smrad stavbe reagira s halogeni Hal 2, ki jih najdemo več v Mendelievovih tabelah. Po takem rangu? opisi vrst reakcij izhajajo iz seznama 1: ZnBr 2 + 2AgNO 3 \u003d 2AgBr + Zn (NO 3) 2 3ZnBr 2 + 2Na 3 PO 4 = Zn 3 (PO 4) 2 + 6NaBr ZnBr 2 + Cl 2 = ZnCl 2 + Br 2 Upravitelj št. 12 Nastavite položaj med imenom govora in razredom/skupino, na kaj (-ї) leži govor: na položaj kože, označen s črko, izberite pravilen položaj, označen s številko. Pod ustreznimi črkami vpiši v tabelo številke izbranih govorov. Pričevanje: A-4; B-2; V 1 Pojasnilo: A) Metilbenzen je enak toluenu, vendar je strukturna formula: Kolikor je mogoče, so molekule tega govora zložene samo v ogljik in vodo, zato je ogljikovim hidratom dodan metilbenzen (toluen). B) Strukturna formula anilina (aminobenzena) je naslednja: Ker je mogoče slediti strukturni formuli, je molekula anilina sestavljena iz aromatskega ogljikovega hidrata (C 6 H 5 -) in amino skupine (-NH 2), v tem vrstnem redu se anilin pripelje do aromatskih aminov, tobto. pravilen predlog 2. C) 3-metilbutanal. Konec "al" je govoriti o tistih, katerih govor sega do aldehidov. Strukturna formula govora: Upravitelj št. 13 Iz predlaganega perelika zavijte dva govora, yakі є strukturni izomeri butena-1. V polje zapišite številke izbranih govorov. Predlog: 2; 5 Pojasnilo: Izomeri se imenujejo govori, ki imajo enako molekulsko formulo in strukturno vrednost, tj. govori, ki se razlikujejo po vrstnem redu atomov, pa tudi po samem skladišču molekul. Upravitelj št. 14 Iz predlaganega perelіku zaviti dve besedi, v primeru interakcije s kalijevim permanganatom, bo mogoče spremeniti zabarvlennya rozchiny. V polje zapišite številke izbranih govorov. Predlog: 3; 5 Pojasnilo: Alkani, pa tudi cikloalkani z razširitvijo obroča 5 ali več ogljikovih atomov, so inertni in ne reagirajo z vodnimi raztopinami, da tvorijo močna oksidanta, kot sta na primer kalijev permanganat KMnO 4 in kalijev dikromat K 2 Cr 2 O 7. Na ta način izpadeta možnosti 1 in 4 - ko se nivoju kalijevega permanganata doda cikloheksan ali propan, se kontaminacija ne bo spremenila. Med ogljikovimi hidrati v homolognem nizu benzena je pasiven na različne vodne sorte oksidira le benzen, pan homologi se oksidirajo v sredini ali v karboksilne kisline ali v hidroksilne soli. V tem vrstnem redu pade varianta 2 (benzen). Pravilna sta 3 (toluen) in 5 (propilen). Žaljivi govori dražijo vijolično barvo kalijevega permanganata zaradi prekomernih reakcij: CH 3 -CH \u003d CH 2 + 2KMnO 4 + 2H 2 O → CH 3 -CH (OH) -CH 2 OH + 2MnO 2 + 2KOH Upravitelj št. 15 Iz predlagane mešanice zavijte dve besedi, z reakcijami formaldehida. V polje zapišite številke izbranih govorov. Predlog: 3; 4 Pojasnilo: Formaldehid je uveden v razred aldehidov - kislih organskih spojin, ki lahko tvorijo aldehidno skupino na koncu molekule: Tipične reakcije aldehidov so reakcije oksidacije in obnove, ki potekajo vzdolž funkcionalne skupine. Sredi spremembe reakcij za formaldehid je značilna reakcija obnova, kot je posredna voda (kat. - Pt, Pd, Ni), in oksidacija - v drugačni reakciji srebrnega zrcala. Z dodatkom vode na nikljevem katalizatorju se formaldehid pretvori v metanol: Reakcija srebrovega zrcala je reakcija odkritja razlike med amonijevim oksidom srebra. Z razliko v vodnem amoniaku se oksid sreble spremeni v kompleksno obliko - hidroksid diaminesrebra (I) OH. Po dodatku formaldehida pride do oksidativno-oksidativne reakcije, v tem primeru opazimo: Vodja št. 16 Iz proponirane mešanice zavijte dve besedi, z reakcijami metilamina. V polje zapišite številke izbranih govorov. Predlog: 2; 5 Pojasnilo: Metilamin je najpreprostejša manifestacija organskih spojin v razredu aminov. Značilna lastnost aminov je prisotnost neporavnane elektronske stave na dušikove atome, po kateri amini pokažejo moč baz in reakcije igrajo vlogo nukleofilov. Na ta način v povezavi s cym iz proponiranih variant metilamina kot baze nukleofil reagira s klorometanom in klorovodikovo kislino: CH 3 NH 2 + CH 3 Cl → (CH 3) 2 NH 2 + Cl - CH 3 NH 2 + HCl → CH 3 NH 3 + Cl - Vodja št. 17 Predvidena je shema za preoblikovanje govorov: Vznachte, yakі іz zaznačenih govora je speakovina X in Y. Pod ustreznimi črkami vpiši v tabelo številke izbranih govorov. Predlog: 4; 2 Pojasnilo: Ena od reakcij je zadrževanje alkoholov in reakcija hidrolize haloalkanov. Na ta način je mogoče vzeti etanol iz kloroetana tako, da ga pijemo na preostalem vodnem travniku – v tej kapljici NaOH. CH 3 CH 2 Cl + NaOH (vod.) → CH 3 CH 2 OH + NaCl ofenzivna reakcija je oksidacijska reakcija etilni alkohol. Oksidacija alkoholov poteka na srednjem katalizatorju ali na bakrovih bazah CuO: Vodja št. 18 Nastavite razliko med imenom govora in izdelkom, kar je pomembnejše, da se vzpostavi v interakciji govora z bromom: na položaj kože, označen s črko, zavzeti drugi položaj, označen s številko. Odziv: 5; 2; 3; 6 Pojasnilo: Za alkane so najbolj značilne reakcije substitucijske reakcije prostih radikalov, pri katerih se atom vode nadomesti z atomom halogena. V tem vrstnem redu lahko bromirani etan odstranimo z brometanom, bromirani izobutan pa z 2-bromoizobutanom: Razpršenost majhnih ciklov molekul ciklopropana in ciklobutana je nestabilna, ko so bromirani cikli teh molekul ukrivljeni tako, da reakcija poteka: Na podlagi ciklov ciklopropana in ciklobutana je cikel cikloheksana velikih rožmarinov, po katerem se vodni atom zamenja z atomom broma: Upravitelj št. 19 Ugotovite razliko med reaktivnimi govori in izdelkom, ki maščuje premog, ki se poravna z interakcijo teh govorov: v položaj kože, označen s črko, zavzemite pravilen položaj, označen s številko. V tabelo zapišite izbrane številke pod dvojnimi črkami. Odziv: 5; 4; 6; 2 Vodja št. 20 Iz predlaganega seznama vrst reakcij izberite dve vrsti reakcij, ki ju lahko uvedemo v kombinaciji z lužastimi kovinami iz vode. V polje zapišite število izbranih vrst reakcij. Predlog: 3; 4 Kovinski bazeni (Li, Na, K, Rb, Cs, Fr) so uvrščeni v glavno podskupino skupine I tabele D.I. Mendelievovi privrženci, ki zlahka prenašajo elektron, se širijo do enakega. Če označujemo lužno kovino s črko M, potem lahko reakcijo mlačne kovine z vodo vidimo takole: 2M + 2H 2 O → 2MOH + H 2 Luže so bile še bolj aktivne, ko so se razširile do vode. Reakcija turbulentno teče iz vizije veliko število toplota, nereverzibilna in ne spremeni katalizatorja (nekatalitičnega) - govora, ki bo pospešil reakcijo in ne bo vstopil v skladišče reakcijskih produktov. Pomembno je, da vse eksotermne reakcije ne spremenijo katalizatorja in potekajo nepreklicno. Krhci kovine in vode so govor, ki je v različnih mlinih agregatov, kjer reakcija poteka med fazami, tudi heterogen. Vrsta reakcije je substitucija. Reakcije med anorganskimi govori se pripeljejo do nadomestnih reakcij, zaradi katerih se preprost govor zloži in posledično se poravnajo drugi preprosti in zloženi govori. (Reakcija nevtralizacije poteka med kislino in bazo, zaradi česar se govor izmenjuje s svojimi skladiščnimi deli in se poravna z močjo in nizko disociacijo govora). Kot je bilo omenjeno zgoraj, so luže metali raziskovalci, pri čemer so elektron prenesli iz zunanje krogle, reakcija pa je oksidirala in oksidirala. Vodja št. 21 Iz predlaganega remiksa ovnishnіh infuzij zavijte dve infuziji, kot da bi spremenili hitrost reakcije etilena z vodo. V polje zapišite številke izbranih klicev. Predlog: 1; 4 za švedščino kemične reakcije dodajte takšne dejavnike: spreminjanje temperature in koncentracije reagentov ter spremenljivko katalizatorja. V skladu z empiričnim pravilom Van't Hoffa, ko se temperatura na koži dvigne za 10 stopinj, se konstanta enakomernosti homogene reakcije poveča za 2-4 krat. Prav tako spremenite temperaturo, da zmanjšate hitrost reakcije. Prva možnost je hoja. Ker je bilo označeno višje, se hitrost reakcije infundira in koncentracija reagentov se spremeni: če se poveča koncentracija etilena, potem rast in hitrost reakcije, kar tovarni ne pomaga. In sprememba koncentracije vode - aktivna komponenta, po drugi strani, zmanjša hitrost reakcije. Tudi druga možnost ni primerna, vendar je četrta možnost primerna. Govor je katalizator, ki bo pospešil kemično reakcijo, vendar ne bo vstopil v skladišče izdelkov. Sprememba katalizatorja bo pospešila reakcijo hidrogeniranja etilena, ki tudi ne kaže pameti rastline, da ni pravi način. Ko etilen interagira z vodo (na katalizatorjih Ni, Pd, Pt), se etan raztopi: CH 2 \u003d CH 2 (g) + H 2 (g) → CH 3 -CH 3 (g) Vse sestavine, ki jih ima reakcija, in produkt so plinasti rehovini, prav tako na pritisk v sistemu vpliva tudi hitrost reakcije. Dvakrat se porabi etilen, ena voda pa se zadovolji, nato pa reakcija na spremembo tlaka v sistemu. S pritiskom na pritisk bomo pospešili reakcijo. P'yata vіdpovіd ne pride. Vodja št. 22 Ugotoviti razliko med formulo soli in produktov z elektrolizo vodne raztopine soli, kot je prikazano na inertnih elektrodah: do položaja kože, Formula soli IZDELKI ELEKTROLIZE V tabelo zapišite izbrane številke pod dvojnimi črkami. Predlog: 1; 4; 3; 2 Elektroliza je oksidacijski in oksidacijski proces, ki poteka na elektrodah med prehodom stalnega električnega toka skozi odprtino in taljenje elektrolita. Na katodi je pomembno opozoriti na prisotnost tihih kationov, ki imajo lahko največjo oksidno aktivnost. Na anodah najprej oksidirajo ti anioni, kot da bi lahko bili najpomembnejša zgradba. Elektroliza vode 1) Postopek elektrolize variacij vode na katodi ne sme biti odložen glede na material katode, temveč glede na položaj kovinskega kationa v elektrokemični seriji napetosti. Za katione v vrsti Li + - Al 3+ postopek obnove: 2H 2 O + 2e → H 2 + 2OH - (H 2 je viden na katodi) Postopek obnove Zn 2+ - Pb 2+: Me n + + ne → Me 0 ta 2H 2 O + 2e → H 2 + 2OH - (H 2 ta Me lahko vidimo na katodi) Cu 2+ - Au 3+ proces obnove Me n + + ne → Me 0 (me je viden na katodi) 2) Postopek elektrolize vodnih razlik na anodi je treba nanesti glede na material anode in naravo aniona. Kot da anoda ni odprta, tobto. inerten (platina, zlato, vugilla, grafit), potem je proces zastarel le v naravi anionov. Za anione F -, SO 4 2-, NO 3 -, PO 4 3-, OH - postopek oksidacije: 4OH - - 4e → O 2 + 2H 2 O ali 2H 2 O - 4e → O 2 + 4H + (kisik je viden na anodi) halogenidni ioni (crim F-) oksidacijski proces 2Hal - - 2e → Hal 2 ) organski Postopek oksidacije kislin: 2RCOO - - 2e → R-R + 2CO 2 Popolnoma enako elektriki: A) razlika med Na 3 PO 4 2H 2 O → 2H 2 (na katodi) + O 2 (na anodi) B) Razlika v KCl 2KCl + 2H 2 O → H 2 (na katodi) + 2KOH + Cl 2 (na anodi) C) razlika med CuBr2 CuBr 2 → Cu (na katodi) + Br 2 (na anodi) D) porazdelitev Cu(NO3)2 2Cu (NO 3) 2 + 2H 2 O → 2Cu (na katodi) + 4HNO 3 + O 2 (na anodi) Vodja št. 23 Nastavite razliko med imenom soli in nastavitvijo soli na hidrolizo: na položaj kože, označen s črko, izberite pravilen položaj, označen s številko. V tabelo zapišite izbrane številke pod dvojnimi črkami. Predlog: 1; 3; 2; 4 Hidroliza soli - interakcija soli z vodo, ki vodi do dodajanja vodnega kationa H + molekul vode k anionu kislega presežka in (ali) hidroksilne skupine OH - molekule vode kovinskemu kationu. Hidrolizo izvajajo soli, nasičene s kationi, ki so primerni za šibke baze, in anioni, ki so primerni za šibke kisline. A) Amonijev klorid (NH 4 Cl) - močan, izdelan iz močne klorovodikove kisline in amoniaka (šibka baza), ki je podvržen hidrolizi s kationom. NH 4 Cl → NH 4 + + Cl - NH 4 + + H 2 O → NH 3 H 2 O + H + (raztopljen v vodi amoniak) Sredina je kisla (pH< 7). B) Kalijev sulfat (K 2 SO 4) - močan, narejen z močno žveplovo kislino in kalijevim hidroksidom (travnik, ki je močna baza), hidroliza ni dovoljena. K 2 SO 4 → 2K + + SO 4 2- C) Natrijev karbonat (Na 2 CO 3) - moč, izdelan s šibko ogljikovo kislino in natrijevim hidroksidom (travnik, ki je močna baza), podvržen hidrolizi z anionom. CO 3 2- + H 2 O → HCO 3 - + OH - (osvetlitev šibko disociiranega hidrokarbonatnega iona) Srednji del luže (pH> 7). D) Aluminijev sulfid (Al 2 S 3) - moč, kaljen s šibko diurinsko kislino in aluminijevim hidroksidom (šibka baza), podvržen popolni hidrolizi s primesjo aluminijevega hidroksida in diuretika: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 + 3H 2 S Sredina je blizu nevtralne (pH ~ 7). Vodja št. 24 Ugotoviti razliko med enakimi kemičnimi reakcijami in neposredno uporabiti kemično izravnavo s povečanim tlakom v sistemu: na položaj kože, označen s črko, zavzeti drugi položaj, označen s številko. REAKCIJE REAKCIJE A) N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) B) 2H 2 (g) + O 2 (g) ↔ 2H 2 O (g) C) H 2 (g) + Cl 2 (g) ↔ 2HCl (g) D) SO 2 (g) + Cl 2 (g) ↔ SO 2 Cl 2 (g) NEPOSREDNO OBLIKOVANJE KEMIJSKIH RIVNOVAGI 1) premik iz neposredne reakcije 2) zm_shchuєtsya pri bik zvorotnoї reakcije 3) ni spremembe ljubosumja V tabelo zapišite izbrane številke pod dvojnimi črkami. Pričevanje: A-1; B-1; Ob 3; G-1 Reakcija je znana v kemijskem razmerju, če je resnost neposredne reakcije višja od resnosti seruma. Usunennya ryvnovagi pri potrebnih neposredno doseže spremembo mišljenja reakcije. Uradniki, ki podpisujejo položaj ljubosumja: - vice: zbіlshennya vice zmіschuє rіvnovag pri bіk reakciji, scho vodi do spremembe glasnosti - temperaturo: zvišanje temperature in odmik izravnave bik endotermne reakcije - koncentracije zunanjih govornih in reakcijskih produktov: povečanje koncentracije zunanjih govorov in povečanje produktov reakcije v sferi reakcije, sprememba neposredne reakcije - Katalizatorji ne pljuvajo na sprejetje ljubosumja, temveč pospešujejo dosežek A) Na prvi stopnji je reakcija na spremembo zaradi sprememb, skaliranje V (N 2) + 3V (H 2)\u003e 2V (NH 3). Pritisk na sistem je enak maščevanju za ubijanje iz manj običajnih govorov, nato pa neposredno (ubijanje neposredne reakcije). B) Drugače je reakcija enaka za spremembe, lestvice so 2V (H2) + V (O2) > 2V (H2O). S pritiskom na sistem izenačite pritisk na neposredno reakcijo (na proizvod). c) Hkrati se reakcijski čas ne spremeni, ker V (H 2) + V (Cl 2) \u003d 2V (HCl), ni enake pristranskosti. D) V četrti fazi je tudi reakcija enaka spremembi, lestvice so V(SO2) + V(Cl2) > V(SO2Cl2). Potiskanje tlaka na sistem, izenačenje tlaka na produktu (neposredna reakcija). Upravitelj №25 Nastavite razliko med formulama govora in reagenta, s pomočjo katerih lahko ločite razlike v vodi: na položaj kože, označen s črko, izberite pravilen položaj, označen s številko. GOVORNA FORMULA A) HNO 3 in H 2 O C) NaCl in BaCl 2 D) AlCl 3 in MgCl 2 V tabelo zapišite izbrane številke pod dvojnimi črkami. Pričevanje: A-1; B-3; Ob 3; G-2 A) Dušikovo kislino in vodo je mogoče ločiti za dodatno sol - kalcijev karbonat CaCO3. Kalcijev karbonat se v vodi ne razlikuje, vendar pri interakciji z dušikovo kislino naredi razliko v jakosti - kalcijev nitrat Ca (NO 3) 2, s katerim reakcijo spremljajo vizije golega ogljikovega dioksida: CaCO 3 + 2HNO 3 → Ca(NO 3) 2 + CO 2 + H 2 O B) Kalijev klorid KCl in travniški NaOH lahko ločimo z različnimi sulfatnimi midi (II). Pri medsebojnem delovanju midi (II) sulfata s KCl reakcija izmenjave ne poteka, ioni K +, Cl -, Cu 2+ in SO 4 2- so prisotni v različni meri, le malo raztopijo enega z eno nizko disociacijo. govora. Pri medsebojnem delovanju midi(II) sulfata z NaOH pride do izmenjevalne reakcije, ki povzroči obarjanje midi(II) hidroksida (osnova črne barve). C) Natrijev klorid NaCl in barijev BaCl 2 - maloprodajne soli, kot tudi maloprodajni sulfat midi (II). Pri medsebojnem delovanju midi (II) sulfata z NaCl reakcija izmenjave ne poteka, ioni Na +, Cl -, Cu 2+ in SO 4 2- so prisotni v različnih stopnjah, le malo pripomorejo k raztapljanju enega z enim nizkim -disociacijski govor. Pri motenju z midi(II) sulfatom in BaCl 2 pride do reakcije izmenjave, ki povzroči obarjanje barijevega sulfata BaSO 4 . D) Aluminijev klorid AlCl 3 in magnezij MgCl 2 se razlikujeta v vodi in se različno obnašata pri interakciji s kalijevim hidroksidom. Magnezijev klorid s travnika postavlja obleganje: MgCl 2 + 2KOH → Mg(OH) 2 ↓ + 2KCl Pri interakciji s travnikom z aluminijevim kloridom nastane oborina, ki se nato razlikuje od raztopljene kompleksne soli - kalijevega tetrahidroksoaluminata: AlCl 3 + 4KOH → K + 3KCl Vodja št. 26 Nastavite položaj med govornim območjem in območjem stosuvannya: na položaj kože, označen s črko, izberite pravilen položaj, označen s številko. V tabelo zapišite izbrane številke pod dvojnimi črkami. Pričevanje: A-4; B-2; Ob 3; G-5 A) Ammiac je najpomembnejši proizvod kemične industrije, njegova proizvodnja je več kot 130 milijonov ton na reko. V glavnem je amoniak vikoren v prisotnosti dušikovih dodatkov (amonijev nitrat in sulfat, sechovin), alkoholnih pijač, vibuhovih govorov, dušikove kisline, sode. Sredina predlaganih variant vidpovidey s sfero stagnacije amoniaka in virobnitstvo dobriv (četrta varianta vіdpovіdі). B) Metan je najpreprostejši v ogljikovih hidratih, toplotno najbolj stabilen predstavnik nizkih mejnih plasti. Yogo je široko vikoristovuyut kot pobutov in promislova, kot tudi sirovini za promyslovnosti (Druga različica vіdpovidі). Metan za 90-98% zemeljskega plina skladišča. C) Guma je ime za materiale, ki so obsedeni s polimerizacijo zaradi pridobivanja subtraktivnih povezav. Izopren je mogoče pripeljati do te vrste s podpičji in zmagoviti pri izbiri ene vrste gume: D) Alkeni z nizko molekulsko maso so vikirani za plastiko, medtem ko so etilenski vikorji vikorirani za plastiko, imenovano polietilen: n CH 2 \u003d CH 2 → (-CH 2 -CH 2 -) n Upravitelj št. 27 Izračunajte maso kalijevega nitrata (v gramih) na naslednji način: v 150 g je razlika z masnim deležem soli 10 %; za vsebnost je razlika z masnim deležem 12 %. (Število zapišite na najbližjih deset.) Vrednost: 3,4 g Pojasnilo: Naj x g - masa kalijevega nitrata, jak rozchinyayat 150 g razchinya. Izračunamo maso kalijevega nitrata, razdeljeno na 150 g: m(KNO 3) \u003d 150 g 0,1 \u003d 15 g Da dodamo 12 % masnega deleža soli, dodamo x g kalijevega nitrata. Masa je zložil razliko pri tsioma (150 + x) r. Rivnyannya bo napisano ob pogledu: (Število zapišite na najbližjih deset.) Vidpovid: 14,4 g Pojasnilo: Zaradi večkratnega raztrganja obtočne vode se raztopita žveplov dioksid in voda: 2H 2 S + 3O 2 → 2SO 2 + 2H 2 O Po Avogadrovem zakonu so tisti, ki so obsedeni s plini, ki so v istih glavah, videti enega proti enemu, tako kot število teh plinov. V tem vrstnem redu za enake reakcije: ν(O 2) = 3/2ν(H 2 S), odslej obsyagi sіrkovodnya in kislost spіvvіdnosya med seboj takole: V (O 2) \u003d 3 / 2V (H 2 S), V (O 2) \u003d 3/2 6,72 l \u003d 10,08 l, zvezde V (O 2) \u003d 10,08 l / 22,4 l / mol \u003d 0,45 mol Izračunajmo maso kislosti, potrebo po novem lomljenju sirkovodnje: m(O 2) \u003d 0,45 mol 32 g / mol \u003d 14,4 g Upravitelj №30 Vikoristovuyuchi metodo elektronskega ravnotežja, zložite enako reakcijo: Na 2 SO 3 + ... + KOH → K 2 MnO 4 + ... + H 2 O Vznachte okislyuvach in vіdnovnik. Mn +7 + 1e → Mn +6 │2 reakcija obnove S +4 − 2e → S +6 │1 oksidacijska reakcija Mn +7 (KMnO 4) - oksidant, S +4 (Na 2 SO 3) - nosilec Na 2 SO 3 + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O Upravitelj №31 Zalizo smo popravili z vročo koncentrirano žveplovo kislino. Otrimanova moč je bila prevelika z natrijevim hidroksidom. Vipavsko viharno obleganje so filtrirali in prepražili. Otrimanov govor je bil razgret od mraza. Napišite seznam več opisov reakcij. 1) Zalizo, tako kot aluminij in krom, ne reagira s koncentrirano žveplovo kislino in se ukrivlja s taljenjem kislega oksida. Reakcija se pojavi samo pri segrevanju z opazovanjem kislega plina: 2Fe + 6H 2 SO 4 → Fe 2 (SO 4) 2 + 3SO 2 + 6H 2 O (pri segrevanju) 2) Solfat (III) - topen v vodi, vstopi v reakcijo izmenjave s travnikom, zaradi česar hidroksid sline (III) pade v obleganje (polrjava barva): Fe 2 (SO 4) 3 + 3NaOH → 2Fe(OH) 3 ↓ + 3Na 2 SO 4 3) Neraztopljene hidroksidne kovine se pri praženju razgradijo na reaktivne okside in vodo: 2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O 4) Pri segrevanju oksida (III) s kovinsko soljo se solni oksid (II) raztopi (trdna snov v FeO ima lahko vmesno stopnjo oksidacije): Fe 2 O 3 + Fe → 3FeO (pri segrevanju) Upravitelj №32 Napišite enake reakcije, s pomočjo katerih lahko ustvarite takšno transformacijo: Pod uro pisanja enake reakcije, vikoristovyte strukturne formule organskih govorov. 1) Intramolekularna dehidracija poteka pri temperaturi nad 140 o C. Posledično se je cepitev vodnega atoma od ogljikovega atoma do alkohola dvignila skozi enega do alkoholnega hidroksida (v β-položaju). CH 3 -CH 2 -CH 2 -OH → CH 2 \u003d CH-CH 3 + H 2 O (pranje - H 2 SO 4, 180 o C) Medmolekularna dehidracija poteka pri temperaturah pod 140 o C z dižveplovo kislino in vodi do razcepitve ene molekule vode na dve molekuli alkohola. 2) Nesimetričnim alkenom lahko dodamo propilen. Ko se dodajo vodikovi halogenidi in se atom vode doda ogljikovemu atomu pri večkratni vezi, ki je povezana z velikim številom atomov v vodi: CH 2 \u003d CH-CH 3 + HCl → CH 3 -CHCl-CH 3 3) Z vodno raztopino NaOH za 2-kloropropan se atom halogena nadomesti s hidroksilno skupino: CH 3 -CHCl-CH 3 + NaOH (vod.) → CH 3 -CHOH-CH 3 + NaCl 4) Propilen se lahko odstrani ne samo iz propanola-1, ampak tudi iz propanola-2 z reakcijo intramolekularne dehidracije pri temperaturi nad 140 o C: CH 3 -CH (OH) -CH 3 → CH 2 \u003d CH-CH 3 + H 2 O (pranje H 2 SO 4, 180 o C) 5) V lužnem mediju, razredčenem z vodnim kalijevim permanganatom, opazimo hidroksilacijo alkenov z odobrenimi dioli: 3CH 2 \u003d CH-CH 3 + 2KMnO 4 + 4H 2 O → 3HOCH 2 -CH (OH) -CH 3 + 2MnO 2 + 2KOH Upravitelj №33 Pomembni masni deleži (%) solnega sulfata (II) in aluminijevega sulfida v seštevku, vendar je bil pri testiranju 25 g vsote z vodo viden plin, ki je bolj verjetno reagiral z 960 g 5 % sulfata midi (II) . Zapišite enako število reakcij, ki so dodeljene miselnim nalogam, in nato dodajte potrebne izračune (navedite enote variacije fizičnih veličin, ki se šalijo). Validacija: ω(Al 2 S 3) = 40 %; ω(CuSO 4) = 60 % Pri obdelavi vsote soli (II) sulfata in aluminijevega sulfida z vodo se sulfat preprosto loči, sulfid pa hidrolizira z aluminijevim (III) hidroksidom in vodo: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 S (I) Pri prehodu obtočne vode skozi sulfat midi (II) padavine izpadajo iz sulfida midi (II): CuSO 4 + H 2 S → CuS ↓ + H 2 SO 4 (II) Izračunamo maso in količino govora mešanega midi(II) sulfata: m (CuSO 4) = m (p-ra) ω (CuSO 4) = 960 g 0,05 \u003d 48 g; ν (CuSO 4) \u003d m (CuSO 4) / M (CuSO 4) = 48 g / 160 g \u003d 0,3 mol Za enake reakcije (II) ν (CuSO 4) = ν (H 2 S) = 0,3 mol in za enake reakcije (III) ν (Al 2 S 3) = 1 / 3ν (H 2 S) \u003d 0,1 mol Preštejmo masi aluminijevega sulfida in midi (II) sulfata: m(Al 2 S 3) \u003d 0,1 mol 150 g / mol \u003d 15 g; m(CuSO4) = 25 g - 15 g = 10 g ω (Al 2 S 3) \u003d 15 g / 25 g 100 % \u003d 60 %; ω (CuSO 4) \u003d 10 g / 25 g 100 % \u003d 40 % Upravitelj №34 Ko spalyuvannі zrazka deyakoї organії ї pol mase 14,8 g vzetih 35,2 g ogljikovega dioksida in 18,0 g vode. Očitno je vpliv govornih hlapov pogostejši 37. Pri raziskovanju kemičnih moči govora je bilo ugotovljeno, da se keton raztaplja v prepletu govora z midi (II) oksidom. Na podlagi teh podatkov razmislite o nalogi: 1) izračunajte številke, potrebne za vzpostavitev molekularne formule organskega govora (navedite enote variacije fizikalnih veličin, ki se šalijo); 2) zapišite molekulsko formulo organskega govora; 3) seštejte strukturno formulo govorne črte, tako da nedvoumno odraža vrstni red povezovanja atomov v prvi molekuli; 4) zapiši enako reakcijo govora z midi(II) oksidom, vikoristično strukturno formulo govora. Določen je rezultat ЄДІ з мії, ki ni nižji od najmanjšega števila žog, ki daje pravico do vpisa na univerze na specialnosti iz predmeta kemija. VNZ nima pravice določiti minimalnega praga za kemikalije pod 36 točk. Prestižne univerze praviloma postavljajo svoj minimalni prag bogastva. Zato imajo lahko dijaki prvega letnika za namene učenja tam več dobrega znanja. Na uradni spletni strani FIPI so široko objavljene možnosti za ED v kemiji: demonstracija, obdobje pred možgansko kapjo. Iste možnosti dajejo izjavo o strukturi prihodnjega spanja in stopnji zlaganja dneva ter є dzherelami zanesljive informacije pri pripravi na ЄДІ. V različicah ЄDI z khіmії 2017 je bilo leto 2017 spremenjeno iz KІM preteklega leta 2016, da se je bilo treba pripraviti na trenutno različico, za pester razvoj diplomantov pa izkoristiti možnosti preteklih let. . Dodatni materiali in posesti V kožno različico pregledovalnega robota ЄDI z chemiї so dodani naslednji materiali: − periodični sistem kemičnih elementov D.I. Mendelev; − tabela soli, kislin in baz v vodi; − elektrokemični niz kovinskih napetosti. Pod uro točkovanja izpitnega dela je dovoljeno preizkusiti neprogramski kalkulator. Prenos dodatnih dodatkov in gradiv, ki jih je dovoljeno narediti na EDI, je potrjen z odredbo Ministrstva za izobraževanje Rusije. Za tiste, ki želite nadaljevati izobraževanje na univerzi, izbor predmetov v maju, odvisno od izbire sprejemnih izpitov za izbrano specialnost Sprememba sprejemnih izpitov na univerzah za vse specialnosti (neposredno usposabljanje) je bila imenovana z odredbo Ministrstva za izobraževanje in znanost Ukrajine. Koža večje začetne zastave je izbrana pri prvem prenosu tistih in drugih predmetov, ki nakazujejo, da jih bom sprejel v lastnih pravilih. Treba se je seznaniti s podatki na spletnih straneh izbranih držav, najprej oddati prijavo za sodelovanje v EDI iz prenosa istih predmetov.GOVORNA FORMULA
REAGENTI
Prestrokova različica ЄDI z khimiї 2017 rіk
Rik
Pridobite varianto pred vrvico
2017
variantapo himii
2016
izkoristiti
Demonstracijska različica ЄDI z khіmії 2017
Možnost zavdan + vіdpovіdі
Pridobite demo možnost
Specifikacija
demo varianta himiya ege
Kodifikator
kodifikator
(Neposredna priprava).