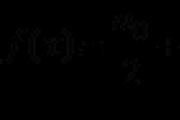Prostornina modrih plinov v kemičnih reakcijah. Avogadrov zakon
Tabor govora podoben plinu. Avogadrov zakon. Molarna prostornina plina.
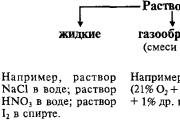
Govor je mogoče reciklirati v treh mlinih agregatov - trdnih, redkih in plinastih. Deli, v tem številu, se oblikuje trdni govor, da bi bil mіtsno pov'yazanі med seboj, k temu trdnemu govoru tvorijo eno samo obliko. Deli trdnih teles so lahko atomi, molekule, ioni, ki tvorijo kristalne strukture. Qi chastki kolivayutsya z majhno amplitudo utrip vuzlіv kristalno ґrat. V domačih regijah so deli vezani ena proti ena šibkeje in jih je mogoče preveč obleči, da je velika razlika. Zaradi tega plinnist in nabreknejo oblike sodnikov, v katerih se pozna smrad.
Prehod govora iz trdnega stanja redko opazimo pri segrevanju, zaradi česar se amplituda cepitve delcev postopoma povečuje. Ko je temperatura visoka, delci govora nabreknejo z zdatnostjo, preplavijo vozle burri, opazimo taljenje. Ko je ohlajen, navpaki, deli rіdini preživijo zdatnіst premakniti in popraviti v položaju za petje, zaradi česar je govor čvrst. Za največje ume se rіdini praviloma trudijo molekularno življenje. Pri visokih temperaturah je struktura rіdini lahko drugačna (taljenje soli in kovin).
Interakcije med molekulami so bogato šibke, nižje med ioni v ionskih kristalnih strukturah; atomi, vezani s kovalentno vezjo v atomskih strukturah; kovinski ioni, vezani z elektronskim plinom v kovinskih strukturah.
Trden in redek tabor govora, s katerim si ustvarimo drzno ime kondenzacijski mlin. Debelina govora v kondenziranem jeklu se spreminja na mejah približno 0,5 - 22,5 g / cm 3. Govor na plinski postaji ima lahko bistveno manjšo debelino - blizu 10 -2 - 10 -3 g / cm 3. Prehod pri plinastem mlinu je posledica segrevanja govorov, ki so v zgoščenem mlinu (vrenje trdnih snovi, sublimacija trdih govorov). Plinu podobne za največje ume govora so sestavljene iz molekul.
Ko se premikajo v plinasto stanje, delci govora dodajo sile medmolekularne interakcije. Obsyag, ki zaseda plin, ki pravzaprav zakriva prosti prostor med molekulami plina, ki se naključno zrušijo. Velikost tega prostora je določena s temperaturo in vice. Ko smo obsyagom, zasedeni s samimi molekulami, se lahko upremo. zvezde kričijo Avogadrov zakon :
Enake obveznosti različnih plinov imajo enako število molekul za iste ume.
Iz zakona Avogadrov krik dve glavni ugotovitvi .
Prva posledica
En mol katere koli vrste plina za iste ume si izposodi isto zastavo. Tsey obsyag se imenuje molarni tlak plina ( V m ) , Kar je vimiryuetsya v m 3 / mol (pogosto v dm 3 / mol). Molarna obveznost do plina je naprednejša, da se plin obvezuje na enako količino:
Vіdomo, scho vrednost V m pasti v vіd glavah (temperatura, tysk). Za dokončanje naloge si je treba zapomniti vrednost V m at normalni umi (n.o.s.) - atmosferski tlak (101,3 kPa) in temperatura ledu (0 0 C ali 273,15 K).
Za normalne misli V m \u003d 22,4 dm 3 / mol, oz
v enotah CI 0,0224 m 3 / mol.
Druga posledica
Širine plinov (ali mase istih plinov) so sestavljene kot molske mase plinov.
Iz takih ogledal se vidi. Prinesite dve porciji različnih plinov iste obveznosti (obveznosti vimirjanov za iste ume). Poznamo jih:
Nastavitev njihove mase:
Yakshcho vikoristovuvat schіlnіst:
Za Avogadrovim zakonom n 1 \u003d n 2 glej:
Sprememba debeline plinov, ki je dražja pri spremembi molskih mas, se imenuje nosilnost enega plina v drugem ( D ). D - vrednost je nedoločena.
Če poznamo D in molsko maso enega plina, je enostavno vedeti molsko maso drugega plina:
; M1 = M2 × D.
uporabite
M(x) = M(H2) × D=2 × 8,5 = 17 g/mol
Plin iz takšne molske mase - amoniak NH 3 .
Izkazalo se bo, da je moč določenega plinastega ogljikovega hidrata dražja za dva. Spremenite svojo molsko maso v ogljikove hidrate.
Zdi se, da je povprečna molska masa 29 g/mol.
M(x) = M(p.) × D=29 × 2 = 58 g/mol
Ogljikov hidrat s tako molsko maso je Z 4 H 10 butan.
Upoštevajte, da so plini z molsko maso manj kot 29 enostavni na ponovitev, več kot 29 je pomembnih.
V rastlinah rozrahunkovyh lahko obstajajo podatki o dušiku, kislosti in drugih plinih. V tem primeru je treba za vrednost molske mase pomnožiti viskozno debelino z molsko maso, podobno kot dušik (28 g/mol), kislo (32 g/mol) itd.
Avogadrov zakon se pogosto uporablja v kemijskih študijah. Oskіlki za pline so sorazmerni s številom govorov, nato pa koeficienti v enakih reakcijah, ki odražajo število reagirajočih govorov, sorazmerno z deleži motečih plinov. Očitno scho obsyagi mayut, vendar vimiryan za iste ume.
zadnjico
Nekaj kislega bo potrebno za lomljenje 2 dm 3 propan? Vymiryan obyagi za n. y.
H 3 H 8 + 5O 2 3CO 2 + 4H 2 O.
Iz Avogadrovega zakona je jasno, da mora biti enako število različnih plinov enako številu molekul in očitno enakemu številu molov govora. Naredimo propan do 1 dm3. Todi, iz enake reakcije, za poparitev 1 dm 3 propana potrebuje 5 dm 3 kislega, 2 dm 3 (dva litra) pa 10 dm 3 Pro 2.
Kemija
Globalna kemija
Osnovni pojmi, zakoni in teorije kemije
Prostornina modrih plinov v kemičnih reakcijah. Avogadrov zakon
Gay-Lussacov zakon denarja
Gazi se med seboj odzivajo ob pesmih splošnega govora. Leta 1808 p. J. L. Gay-Lussac, ki je vzpostavil naslednje pravilo: Količino plinov, ki vstopijo v reakcijo, lahko vidimo en proti enemu tistih plinom podobnih produktov v reakciji, kot majhna števila.
Vіdkritiy vchenim zakon vidomy v kemiji jak zakon volumnov b. Za jogo je potrebno, da plini, ki sodelujejo v reakciji, ostanejo pri isti temperaturi in tlaku.
Vіdnoshennia obsyagіv gazіv, scho za vstop v kemično reakcijo, vіdpovіdat koeficienti enaki, na primer: .
V tem primeru 3 volumna vode reagirajo z 1 volumnom dušika, zaradi česar se raztopita 2 volumna amoniaka, tako da se pokaže spontanost.
Upravitelj. Kakšna je potrebna reakcija vode za 2 m 3 dušika?
Rešitev
Iz enake reakcije je razvidno, da je kriva prostornina vode, vendar 3-krat večja za prostornino dušika:
obsyag voda m3.
Avogadrov zakon
Za razlago preprostega spіvvіdnoshenі mіzh vzyagyah reakcijskih plinov vikoristovuyut Avogadrov zakon: Enaki tlaki različnih plinov za iste ume (temperatura in tlak) imajo enako število molekul.Nisem pustil, da bi Avogadrov zakon zacvilil dvakrat ta:
1) En mol katere koli vrste plina za iste ume si izposoja isto obveznost.
Za normalne misli (n.a.), potem pri temperaturi 273 K in vice 101,3 kPa (1 atm) 1 mol katerega koli plina zavzame prostornino, ki je enaka 22,4 litra. Tsei obsyag klic molarni plin i pomeni l/mol.
Molarno vez je mogoče zrahljati s formulo
.
2) Pri konstantnem tlaku je ta temperatura plinske reže manjša od ene molske mase.
Tse vam omogočajo, da napačno razumete prepustna debelina prvi plin na drug način:
,
de D- vidno schilnist, kot kaže, hkrati je prvi plin pomemben za drugega za iste ume.
Najpogosteje lahko vikorist vidi vodo skozi plin. Todi:
; .
Za vsak plin je mogoče zrahljati gosto goščavo.
Čigava distribucija vikoristan materialov metodični asistent"Navchannya rozvyazannyu problemi kemije". Avtorji - skrbniki: učitelj kemije najvišje kategorije, metodik Zavoda za šolstvo "Gimnazija št. 1 mesta Grodno" Tolkach L.Ya.; metodologinja začetno-metodičnega oddelka Zavoda za šolstvo "Grodno OIPK in PRR in SV" Korobova N.P.
Izračun števila molskih volumnov plinov.
Izračun izrazite goščave plinov.
Volumen modrih plinov
En mol katere koli vrste plina za iste ume zaseda prav istega. Torej, za normalne misli (n.o.),tobto. pri temperaturi 0 °C in normalni atmosferski tlak, ki je 101,3 kPa, en mol katerega koli plina zaseda prostornino22,4 dm3.
NastavitevPlin obvezujem določeni kemični količini govora - vrednosti, kot se ji rečemolarni tlak plina (Vm):
Vm = V/ ndm 3, zvezdiceV = Vm · n
Za izbiro: najlažji ali najpomembnejši plin je enak drugemu plinu, je dovolj, da izenačimo njihovo debelino:
r 1 / r 2 = M 1 V 1 / M 2 V 2 = M 1 / M 2 = D 2.Z vidika induciranega viroza je jasno: izenačiti širino plinov, doseči izenačitev njihovih molskih mas.
Razmerje med molsko maso enega plina in molsko maso drugega plina je vrednost, kot se imenuje
zaznavni prostor ( D 2 ) en plin z drugim plinom.Če poznate moč enega plina v drugem, lahko izračunate molsko maso:
M
1 = M 2 · D 2 .Če vidite vsoto plinov, je ta "molarna masa" enaka masi s prostornino 22,4 litra. Vrednost Tsya je številčno naprednejša:
M pov. = 29 g/mol
Očitno do Avogadrovega zakona enako število molekul različnih plinov za mirne ume same vzame enako količino.
Iz tega je razvidna še ena posledica.
Pri stalnih temperaturah in tlaku začnejo plini reagirati ena proti ena, pa tudi v obsegu plinu podobnih produktov, ki se usedajo kot majhna števila.
Ta zakon je Gay-Lussac oblikoval kot zakon prostornine plinov. Na ta način, če kemična reakcija prevzame svoj delež ali se pojavi plinski govor, potem je za enake reakcije mogoče namestiti količine modre barve.
Obsyagi plini, na katere reagirajo, so sorazmerni s kemičnimi količinami teh govorov:
V 1 / V 2 = n 1 / n 2 tobto. V 1 in V 2
številčno enaki koeficienti enakih reakcij.primer 1. Balon vsebuje 0,5 kg stisnjene vode. Kakšen volumenizposoditi tako veliko količino vode? odplakniti normalno.
rešitev:
1. Izračunajte kemično količino
voda, kaj maščevati v balonu:N
(H 2) \u003d 500/2 \u003d 250 (mol), de M (H 2) = 2 g / mol.2.Oskіlki za normalne misli 1 mol katerega koli plina porabi skupaj 22,4
dm 3, torejV = Vm · n, V( H 2 ) = 22,4 * 250 = 5600 (dm 3)
Vidpovid: 5600 dm 3
zadnjica 2. Kakšno skladišče (v %) aluminijeve srednje zlitine, kot pri testiranju 1 g presežka joda klorovodikove kisline, je bilo 1,18 l voda?
rešitev:
1. Samo aluminij lahko torej vstopi v reakcijo s kislinonapiši enako:
2A1 + 6HC1 = 2A1C1 3 + 3H 2
2mol 3mol
2. Izračunljivo kemična količina voda:
n(H 2 ) = 1,18/22,4 = 0,05 (mol)
3. Na podlagi reakcije izračunamo maso aluminija,kaj skriti v zlitini:
3 mol 2 mol aluminija
0,05 mol videti vodo, kot da bi reagiralxmol aluminij
x \u003d 0,05 2/3 \u003d 0,033 (mol),
m( Al) = 0,035 27 = 0,9 (g), de M(Al) = 27 g/mol
5. Izračunljivo masni delež aluminija v kovini:
w(Al) = m ( Al ) / m (zlitina) , w( A1) = 0,9/1 = 0,9 chi 90%.
Todi masni delež midi zlitine 10%
Tip: 90% aluminij, 10% midi
primer 3. Pomembna moč: a) Ponovil bom,b) voda z ogljikovim dioksidom.
rešitev:
1. Znano je videti kislost kislega, ko ga pogledaš:
D povit (Pro 2) =M(Pro 2)/M (pov.) = 32/29= 1,1.
2. Prisotnost ogljikovega dioksida lahko vidimo po voda
D H2 (CO 2) =M(Z 2)/M(H 2) \u003d 44/2 \u003d 22.
Vidpovid: 1,1; 22
zadnjica 4. Določite prostornino plinov, ki dodajo do 0,5 mola kislega, 0,5 mola vodein 0,5 mola ogljikovega dioksida.
rešitev:
1. Poznamo kemično količino vsote plinov:
n(sumish) \u003d 0,5 + 0,5 + 0,5 \u003d 1,5 (mol).
2. Izračunajte skupno količino plinov:
V(sumish) \u003d 22,4 1,5 \u003d 33,6 (dm 3).
Širina: 33,6 dm 3 sum
Primer 5. Izračunajte prostornino ogljikovega dioksida, ki se izpusti pri pljuvanju 11,2 m 3 metan CH 4 .
rešitev:
1. Zapiši kemijsko reakcijo zgorevanja metana:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
1 Krt1 Krt
1 m 3 1 m 3
2. Za izračun količine ogljikovega dioksida seštejemo in spremenimo delež:
pri spanju 1 m 3 CH 4 weide 1 m 3 2
pri spanju 11,2 m 3 CH 4 viide x m 3 2
x \u003d 11,2 1/1 \u003d 11,2 (m 3)
Vidpovid: 11,2 m 3 ogljikov dioksid
Primer 6. Jeklen cilinder za zbiranje stisnjenih plinov je bil napolnjen z redko kislo maso 8 kg.
Kateri obsyag si je izposodil plin iz bencinske črpalke (n.o.)?
rešitev:
1. Izračunajte kemično količino redke kisle:
n( O 2 ) = 8000/32 = 250 (mol).
2. Izračun plinaste kisline:
V( O 2 ) \u003d 22, 4 250 \u003d 5600 dm 3.
Vidpovid: 5600 dm 3
Primer 7. Izračunaj maso s prostornino 1 m 3 (n.o.), kar je 78 volumnov dušika, 21 - kislega, 1 - argona (crym drugih plinov).
rešitev:
1. Vyhodyachi z zavdannya, obsyagi gazіv vіtrі vіdpovіdno dorovnyuyut:
V( N 2 ) \u003d 1 0,78 \u003d 0,78 m 3;
V(Pro 2) \u003d 1 0,21 \u003d 0,21 m 3
V(Ar) \u003d 1 0,01 \u003d 0,01 m 3.
2. Izračunajte kemično količino kožnega plina:
n( N 2 ) \u003d 0,78 / 22,4 10 -3 \u003d 34,8 (mol),
n(Pro 2) \u003d 0,21 / 22,4 10 -3 \u003d 9,4 (mol),
n(Ar) \u003d 0,01 / 22,4 10 -3 \u003d 0,45 (mol).
3. Izračunaj maso plinov:
m(N 2 ) = 34,8 28 = 974 (g),
m(Pro 2 ) = 9,4 32 = 30 (g),
m(Ar) = 0,45 40 = 18 (d).
4. Vsakič izračunaj maso:
m(Ponovite) \u003d 974 + 301 + 18 \u003d 1293 (g) ali 1,293 kg.
Teža: 1,293 kg na dan
Primer 8. Ko podpalyuvanni v evdiometriji sumish kislo in vodo s prostornino 0,1 m 3 skupna vsota se je spremenila za 0,09 m 3 .
Yaki obljubljavoda in kisla sta bila na izhodu sumishi, kot plin, kaj je ostalo, goreče (n.o.)?
rešitev:
1. Zapiši enako reakcijo:
2H 2 + Pro 2 = 2H 2 Pro
2 mol 1 mol 2 mol
2. Očitno je, da so plini, ki so vstopili v reakcijo.
zavezan plinska vreča je hitela po rahunci sladke vode, na katero so plini, ki so vstopili v reakcijo, dosegli 0,09 m 3 .
Ker gasi vstopijo v reakcijo s hitrostjo 2:1, nato od 0,09 m 3 dva dela
pade na vodo in ena - na poljubu. Oče, reagiraj
vpisana 0,06 m 3 vode in 0,03 m 3 kislo.
3. Izračunajte količino plina v skupni količini.
Ker plina, če se preliva, gori, potem je cel dan 0,01 m 3 .
V(H 2 ) = 0,01 + 0,06 = 0,07 (m 3 ) ali 70 l,
V(Pro 2 ) = 0,1 - 0,07 = 0,03 (m 3 ) ali 30 l.
Predlog: 70 litrov vode, 30 litrov kislega
Primer 9. Kakšna je razlika med količino vode v mešanici plinov, ki ji dodamo do 56 litrov argona in 28 litrov dušika (n.o.)?
rešitev:
1. Vyhodyachi z vyznachennya vіdnoї gustina gazіv,
D H 2 = M (noro) / M(H 2 ).
2. Izračunaj kemično količino in maso vsote plinov:
n(Ar) = 5,6/22,4 = 2,5 (mol);
n(N 2 ) = 28/22,4 = 1,25 (mol);
n(sumish) \u003d 2,5 + 1,25 \u003d 3,75 (mol).
m(Ar) = 2,5 40 = 100 (g),
m(N 2 ) = 1,25 28 = 35 (g),
m(sumish) \u003d 100 + 35 \u003d 135 (g), ker
M (Ar) = 40 g/mol, M (N 2 ) = 28 g/mol.
3. Izračunajte vsoto molske mase:
M (povzetek) = m (noro) / n (noro) ;
M (sumish) \u003d 135 / 3,75 \u003d 36 (g / mol)
4. Izračunajte skupno količino plina v vodi:
D H 2 = 36/2 = 18.
Datum: 18
zadnjica 10. Ali lahko zažgete 3 g lesene vugill na trilitrski bantz, napolnjen s kislim (n.o.)?
rešitev:
1. Zapiši enako reakcijo gorskega vugila:
W + Pro 2 = TAKO 2
1 mol 1 mol
2. Izračunajte kemično količino vugill:
n(Z) = 3/12 = 0,25 (mol), torej M (C) \u003d 12 g / mol.
Enaka bo tudi kemična količina kislega, potrebna za reakcijo 0,25 mol
3. Izračunajte količino kislega, ki je potrebna za lomljenje 3 g vodke:
V(O 2 ) = 0,25 22.4 = 5,6 (l).
4. Oskіlki plin izposoja prostornino posode, v istem vinu je znano, je 3 litre kisline. Otzhe, ne šivaj kilkos za spalyuvannya 3 g vugillya.
Nasvet: ne šivajte
zadnjica 11. Ali za kolikokrat povečajo volumen redkih voda v prihodnosti preoblikovanja v par pri n.s.?
Za kemične reakcije aA + bB = cC + dD
zbuditi se
de nA in nB - število prostih govorov, ki so se odzvali, ps in nD - število raztopljenih produktov, a, b, c in d - stehiometrični koeficienti.
Iz števila govorov je enostavno iti na njihovo mašo:
Pri govorih, podobnih plinu, je pogosteje, da chi označujejo njihove obveznosti. Če sta reagent in produkt D plina, izvedite prehod s števila kosti teh govorov na njihovo:
![]()
Za vіdomih (na um) količino, masi ali oblige (za plin) enega od govorov, ki sodelujejo v reakciji, je mogoče razbrati vrednosti vseh količin za druge govore.
Za različne vsote plinov A in B, od katerih eden sodeluje v reakciji, lahko poznate sp_v_dnoshnenja їkh vvyagіv VA: VB, in glede na spіvvіdnosnі - їkh obsyag sumіshi (ali navpaki).
Butt rozvyazannya naloge
Pri visoki temperaturi magnezij reagira z dušikom, poglejmo vsoto argona, s skupno prostornino 5,6 l (N.O.) in dodamo 15 g nitrida. Izračunajte prostornino plinov V(N2): V(Ar) pri izstopni vsoti.


Naloga za samostojna rešitev del A
1. 6 l dušikovega oksida (II) je reagiralo s 5 l kislega
2. V zaprti posodi smo zgoreli 24 g grafita v 67,2 l (n.a.) kislega in odstranili volumen kislega: produkt je enak
3. Skozi ozonator je prešlo 7,5 mol kislega, ki se je pogosto spremenilo v ozon. Po barvanju za "soljenje" (za normalne ume) ostane 0,5 mola vode iz krvi (vrne se v SO2); kasneje je volumen O3: O2 na izhodu iz ozonizatorja postal
4. Kalijev bromid z maso 142,8 g, ki je kalciferno reagiral s klorom, ga bomo vzeli v enaki količini ponovitev v volumetričnem razmerju 1 (klor): 2 (ponovitev). Galny obsyag (v litrih)
5. Za popolno zgorevanje 17,92 l (n.o.) sumish CH4 + H2 je bil potreben 1 mol kisle. Na koncu dneva je skupna količina CH4:H2 bolj izrazita:
6. Plin A smo pri praženju 0,04 mol KClO3 na katalizatorju sneli (pri na) posodo s plinom B, kar smo videli, ko smo testirali 6 g kalcija z vodo, in odvzeli vsoto volumnov A: B, enako
7. Po pljuvanju nitrobenzena v presežno kislost vsote produktov (dušik, ogljikov dioksid, voda), v kateri se odstrani 4 litre (na) dušika, prostornina N2:O2 pa je več kot 4:1. v litrih , n . u.) kislo
8. Izvedena termična razgradnja 1 mol amonijevega klorida v jeklenem balonu, ki je vseboval tudi 11,2 l (n.a.) amoniaka. Kіntseve ob'єmne vіdnoshennia NH3: НCl dorovnyuє
9. Sumish kislo in klor z volumnom 9:1 vicoristan za videnje 0,5 mola preprostega govora z razponom KI
10. Kissen smo spustili skozi ozonator, ko smo na katalizatorju pražili 1 mol KClO3, ko je bilo praženih 5 % kislega, se je kislo spremenilo v ozon in na izhodu iz ozonizatorja se je volumen O2: O3 zmanjšal.
Fizikalno-kemijske zakonitosti oblikovanja tankotaljenih kovinsko-polimernih sistemov iz plinske faze
Tanko staljeni kovinsko-polimerni materiali (kovinski polimeri, kovinske plošče s tankimi polimernimi premazi, bogati kroglični sistemi itd.), ki so oblikovani z vakuumsko tehnologijo.
Epitaksialna rast Ge na Si(100) površinah
Od fizike tankih madežev, dosega obetov za nadaljnji razvoj mikroelektronike, optike, armature in drugih pripomočkov nove tehnologije. Uspehi mikrominiranja elektronskih...
Komponente, ki so lahko močne in zmanjšajo gorljivost polimernih materialov
Kmalu kasneje se bo gospodarstvo države rešilo pred več sto milijoni rubljev. Pri gorenju polimernih materialov se vidi veliko število strupeni plini, ki so škodljivi za ljudi in ...
Cilji lekcije:
Pregled namesto dokumenta
»Kemijski razred 9 Prostornine modrih plinov v kemijskih reakcijah. Izračun skupne porabe plinov za kemijske enakosti.
Lekcija kemije na temo »Prostornina modrih plinov v kemijskih reakcijah. Izračun skupne porabe plinov za kemijske enakosti"
Lekcija #3 o tehniki kritične misli
Cilji lekcije: oblikovati znanje o zakonu volumnov vode za plinasti govor iz ozadja kemičnih reakcij organskega govora; tvorijo zakon o'mnih spіvvіdnoshen za rozrahunkіv іz khіmіchnyh rivnyan. Dodoskonaljuvati vminnya uchnіv virіshuvati rozrakhunkovі zavdannya shdo rіvnyan khіmіchnih reaktsіy. Razviti vmіnnya uchnіv skladišče khіmіchі zavdannya. Razvijte kritične misli. Oblikujte pozitivno nastavitev, dokler predmet ni končan, seštevek nastavitve pred koncem naloge.
Lastništvo: naloge kartice.
Skrita lekcija.
jaz.Ogreti se(Učenci se izgubijo v svojih mislih)
A. Frans "Če človek razmišlja, ne bo sumniven, ne bo pa navdušen, če ..."
Kako ste končali ta stavek?
Naučite se vaditi v skupinah. Zapišite predlagane možnosti. Izberite tі, yakі na їhnyu dumku fit več.
Vinovok: "Če človek misli, se ne bo zmedel, ne bo pa zapel, če je."
I spodіvayus, scho na desni, s katerim smo zaposleni pri lekciji, da vas udarim in pokazali boste svojo živahnost v sedanjosti.
II. Motivacija za učno dejavnost.
Osupnjen nad tistimi, ki je vodja lekcije.
S. Koraki posodobitve
Za diagramom V_den uganite kemično moč alkenіv in alkіnіv.
Zakaj ti je mar molarna kontrakcija karkoli plina za n.s.
predlog: 22,4 l/mol
Kako je formuliran Avogadrov zakon?
predlog: Pri enakih obveznostih različnih plinov, za iste ume (t, p), se maščuje enako število molekul.
Visnovok: Količine plinastih reagentov in produktov reakcije so usklajene tako, da so njihovi koeficienti v reakciji enaki. Tsya zakonіrnіst vikoristovuєtsya za khіmіchnyh rozrahunkіv.
Ustvarjalna naloga:(Daje vam priložnost, da premislite z močnim znanjem znanstvenikov o tej temi)
V treh oštevilčenih epruvetah, zaprtih z zamaški, je: metan, etilen, acetilen. Kako prepoznati, kje je plin poznati?
IV. Koraki obveščanja(Spoznavanje snovi, ki temelji na problemih, iskanje resnice).
Predavanje je bilo okrepljeno (»Vrtiljak«: osnovno razumevanje, kako je poročni dan podan na začetku; po koncu se študenti združijo v stavo, dobijo podobne naloge; seštejejo isto nalogo, kot poročni dan itd. .)
Prostornina klora (n.o.), ki reagira s 7 litri propena, je:
a) 14 l; b) 10 l; c) 7 l; d) 22,4 litra.
3. Izračunajte skupni znesek denarja, ki ga potrebujete za raztrgan sumishi,
doda do 5 l etilena in 7 l acetilena (n.o.).
Navedite, kolikšen volumen vode je potreben za popolno hidrolizo 7 litrov etilena, dokler reakcija ni enaka:
Z 2 H 4 + H 2 \u003d Z 2 H 6 a) 7 l; b) 6 l; c) 14 l; d) 3,5 litra.
Pari delajo. Učenci, združeni pri stavi, so sestavili podobna naročila, kot par virishu sudidnya:
Količina vode, potrebna za popolno zalivanje, je 15 litrov butina, več: a) 15 litrov; b) 30 l; c) 7,5 l; d) 3,5 litra.
Vsakemu volumnu klora dodamo 5 l acetilena, odvisno od reakcije C 2 H 2 + 2Cl 2 \u003d C 2 H 2 Cl 2
a) 5 l; b) 10 l; c) 2,5 l; d) 22,4 litra.
3. Izračunajte skupne stroške, saj jih je treba porabiti za varčevanje
10 m3 acetilena (N.O.).
V. Odsev
Vikonannya naloga s kartice.
Izračunajte skupno količino vode, potrebo po večkratnem zalivanju govora X.
(Naučite se samostojno izpolnjevati tabelo, po zaključku dela bodo odgovorili na vprašanja).
| Obsyag govor X, l | Formula govora X | Rivnyannya gidrovannya | voda, l |
|
VІ . Visnovki iz lekcije
Formulirana je naloga prihodnje lekcije.
VІ jaz. Torbice za lekcijo
VIII. Domača naloga
Propratsiuvati odstavek 23, vikonati desno 206, 207 na strani.