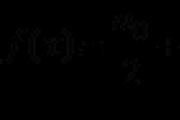Interakcija kemičnih elementov. "Interakcija atomov v elementih-nekovinah med seboj" (8. razred)
Cilji lekcije:
- Spoznajte različne vrste kemičnih vezi.
- Ponovite sheme za govor z drugačno vrsto povezave. Nadaljujte z oblikovanjem in jih zapišite na zaloge.
- Porіvnyati različni tipi zv'azku.
Naloga lekcije:
- Zaprite razumevanje elektronegativnosti kemični elementi, ki vidijo kovalentno vez: polarne in nepolarne;
- Pravilno v mislih zlaganje elektronskih, strukturnih formul, ki pojasnjujejo mehanizem vzpostavitve kovalentnih vezi; vikoristovuvaty nabutі znannya, da vmіnnya praktіyіy dіyalnostі;
- Sprejmite razvoj komunikativnega uma;
- Razvijte logične misli.
Osnovni izrazi:
- Kovine - vsi kemični elementi, katerih atomi zlahka oddajajo lastne elektrone, ki se preoblikujejo v pozitivne ione.
- Nemetali - isti kemični elementi, katerih atomi prejemajo elektrone na normalni ravni, ki se preoblikujejo v negativne ione
- Іoni - delci so nabiti, na katere se atom transformira po dostavi ali sprejemu elektronov.
- Elektronegativnost - gradbena vrednost atom kemični element, da pritegne elektrone drugega atoma.
- Kemični zvok
- metoda interakcije atomov, ki vodi do vzpostavitve molekul.
SKRILA LEKCIJA
Interakcija atomov med elementi in nekovinami
Prvič ugibajmo, kako izgleda periodni sistem elementov in je v njem viden kovina, nekovina, metaloid. Prosim, pomagajte nam s sliko 1.
Mal. 1. Periodični sistem elementov
Zloveščo kroglo atomov nekovin je treba maščevati od 4 do 8 elektronov.
Vignatok: H (1e); Chi ne (2e); (3e)
Polmer atomov nekovin je manjši od polmera atomov kovin.
Kemični elementi se ne mečejo iz periodnega sistema na storž glavnih podskupin, začenši s tretjo skupino in zadnjimi obdobji, tobto. v zgornjem desnem delu periodnega sistema. Dojenček 2.
Mal. 2. Oztashuvannya nekovin v periodičnem sistemu
Kemična moč nekovin
Kemični elementi-nemetalci lahko delujejo kot oksidanti, zato dajejo moč, padejo v kemično preobrazbo, v kateri smrad vzame svojo usodo.
Atomi najbolj elektronegativnega elementa - fluora - ne dajejo elektronov, vedno kažejo le oksidacijsko moč, drugi elementi lahko pokažejo in dajejo moč, četudi bogatejši na svetu, nižje kovine. Najmočnejši oksidanti so fluor, kisikovo gorivo in klor, najbolj močni so voda, bir, premog, silicij, fosfor, mish'yak in telur. Promіzhnі okislyuvalno-vіdnovі vіdnovі vіdnovnі vіdnovі vіlіvі vіstі vіtіt dušik, іrka, jod.
Interakcija s preprostimi govori
1. Interakcija s kovinami:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
v teh vibracijah nekovine kažejo oksidacijsko moč, smrdi sprejemajo elektrone, zaradi česar so delci negativno nabiti.
Na videu si lahko ogledamo interakcijo natrija s klorom
2. Interakcija z drugimi nekovinami:
v povezavi z vodo večina nekovin kaže oksidacijsko moč, ki zadovolji vodo-polkovalentne hidride:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
vzaimodiyuchi s kislo, vse nevrženo, smetano do fluora, kažejo vplivno avtoriteto:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
pri interakciji s fluorom fluor oksidira, kisen pa je vodilo:
2F2 + O2 = 2OF2;
nekovine medsebojno delujejo, bolj elektronegativna kovina igra vlogo oksidanta, manj elektronegativna kovina ima vlogo nosilca:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.
Poglejte kovalentne polarne in nepolarne povezave na malčkih. Pripeljite na zadnjice elementov, kot bi jih dali malčkom.
Mal. 3.
Mal. 4. Kovalentna nepolarna povezava
Na videu 2 si lahko ogledate in poslušate kovalentno nepolarno povezavo
Predmeti > Kemija > Kemija 8. razredprijeten
Pravila za registracijo koristuvachs na spletnem mestu "ZNAK JAKOSTI":
Blokirana je registracija podobnih koristuvachov: 111111, 123456, yutsukenb, lox і.t.p;
Zaščiten s ponovno registracijo na spletnem mestu (ustvarjanje dvojnega računa);
Zaščita podatkov drugih;
zaboronyaetsya vikoristovuvat e-poštne naslove drugih ljudi;
Pravila ravnanja na spletnem mestu, forumih in v komentarjih:
1.2. Objava v vprašalniku posebnih podatkov za ostale študente v ožjem izboru.
1.3. Ne glede na to, ali je uničujoč za ta vir (uničujoči skripti, obnovitev gesla, poškodbe varnostnega sistema).
1.4. Vikoristannya kot vzdevek nespodobnih besed in viraziv; vislovív, kot kršitev zakona Ruska federacija, etične in moralne norme; besede in besedne zveze, podobne vzdevkom administratorjev in moderatorjev.
4. Pomanjkljivosti 2. kategorije: Kaznova se z novo ograjo na upravi, ali so na linijah do 7 deb kakšne vrste armature. 4.1 Razširjanje informacij, ki sodijo v okvir kazenskega zakonika Ruske federacije, upravnega zakonika Ruske federacije in ustave Ruske federacije.
4.2. Propaganda v kakršni koli obliki ekstremizma, nasilja, krutosti, fašizma, nacizma, terorizma, rasizma; rozpalyuvannya medetnična, medverska in socialna vorozhnech.
4.3. Napačno obravnavana dela in slike na naslovu avtorjev besedil in opomb, objavljenih na straneh "ZNAKA JAKOSTI".
4.4. Grožnja na naslove udeležencev foruma.
4.5. Razširjanje neresničnih informacij, klevetanje tistih drugih izjav, ki blatijo čast in dostojanstvo tako coristuvachi kot drugih ljudi.
4.6. Pornografija v avatarjih, citatih in citatih, pa tudi objava na pornografskih slikah in virih.
4.7. Odprite razpravo med skrbniki in moderatorji.
4.8. Javna razprava o tej oceni uradnih pravil v kakršni koli obliki.
5.1. Mat to kletvice.
5.2. Provokacije (posebni vipadi, posebna diskreditacija, oblikovanje negativne čustvene reakcije) in krog udeležencev v razpravi (sistematično zmagovite provokacije stopetdesetih udeležencev).
5.3. Provociranje koristuvachiv v konflikt enega za drugim.
5.4. Nesramnost in nesramnost v smislu vzgoje spivrozmovnikov.
5.5. Prehod na posameznike in z'yasuvannya osobistih vіdnosin na forumu.
5.6. Poplava (identične ali nediagnosticirane informacije).
5.7. Navmisne je napačno zapisal psevdonime in imena drugih koristuvačev v figurativni obliki.
5.8. Redaguvannya citati voіdomlen, scho soporuє їkh zmіst.
5.9. Objava posebnega seznama brez jasnega izražanja duha vohuna.
5.11. Destruktivno trolanje - namen pretvoriti pogovor v spopad.
6.1. Opomnik o prevelikem citiranju (pretiranem citiranju).
6.2. Vicoristannya pisava rdeče barve, priznana za koriguvannya in spoštovanje moderatorjev.
6.3. Nadaljevanje razprave o temah, ki sta jih zaprla moderator in administrator.
6.4. Ustvarili so jih tisti, ki nimajo pomenskega poudarka, ampak so zaradi tega provokativni.
6.5. Ustvarjanje naslova po temah ali z istimi črkami, pogosto z velikimi tiskanimi črkami ali z moja tuja. Vinyatok se bori za naslove objavljanja tem in teme, ki so jih odobrili moderatorji.
6.6. Ustvarite podpis v večji pisavi, znižajte pisavo objave in odštejte podpis v več kot eni barvi palete.
7. Sankcije, yakі zastosovuyutsya za kršitelje pravil foruma
7.1. Timchasova ali postavite ograjo za dostop do foruma.
7.4. Pogled na oblіkovogo zapis.
7.5. IP blokiranje.
8. Opombe
8.1 Sankcije moderatorjev in administracije se lahko izvajajo brez pojasnila.
8.2. Ta pravila se lahko spremenijo, o čemer bodo obveščeni vsi udeleženci spletnega mesta.
8.3. Coristuvachas so zasedeni z vikorističnimi kloni v obdobju ene ure, če je glavni vzdevek blokiran. Na ta način se klon blokira brez črte, glavni pa odstrani dodatno doba.
8.4 Opozorila o nespodobnem jeziku lahko ureja moderator ali administrator.
9. Uprava Uprava strani "ZNAK JAKOSTI" si pridržuje pravico do prejema kakršnih koli informacij brez pojasnila. Uprava spletnega mesta si pridržuje pravico do urejanja profila dopisnika, saj informacije v njih pogosto kršijo pravila forumov. Podrobnosti so razširjene na moderatorje in skrbnike. Uprava si pridržuje pravico, da po potrebi spremeni ali dopolni Pravila. Nepoznavanje pravil ne zadošča za korupcijo. Uprava spletnega mesta ni pristojna za pregled vseh informacij, kot da bi objavljala vsebino. Vsa mnenja odražajo samo avtorjevo misel, vendar ne morejo biti vikoristan, da bi v hipu ocenili misli vseh udeležencev foruma. Obveščanje mesta spіvrobіtnikіv in moderatorjev є viraz їhnої posebne misli in se morda ne bojijo uredništva in mesta kerívnitstva.
I. Klasifikacija kemičnih vezi
1. Za mehanizmom vzpostavitve kemične vezi
a) menjavače poškoduje atome, ki vzpostavljajo povezavo, ji dajte za to neparne elektrone.
Na primer, raztopina vodnih molekul H2 in klora Cl2:
b) darovalec-sprejemnik če je eden od atomov pripravljen na povezavo, bom pripravil par elektronov (donorja), drugi atom pa bo izpraznil prazno orbitalo.
Na primer, amonijev ion (NH4) + (napolnjen del):
2. Za metodo upogibanja elektronskih orbital
a) σ - zv'azok (sigma)če največje prekrivanje leži na črti, je središče atomov zadaj.
na primer
H2 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
b) π - zvyazku (nі) tako da največje prekrivanje ne leži na črti, ki je za središčem atomov.
3. Za potjo do dokončane elektronske lupine
Koža atoma ni sposobna dokončati svoje nove elektronske lupine in sredstev za dosego takšnega cilja je lahko malo.
|
Znak poravnave |
kovalentna |
Ionna |
Metaleva |
|
|
nepolarni |
polarno |
|||
|
Kako je mogoče dokončati elektronsko lupino? |
Vtičnica za elektroniko |
Vtičnica za elektroniko |
Prenos elektronov, prevzem ionov (nabitih delcev) je novost. |
Uzagalnennya elektronіv usіma atomov v Kristusu. ghratah |
|
Kako sprejeti usodo atomov? |
nіme - nіme EO = EO |
1) Nemeth-Nemeth1 2) Met-nimet EO< ЭО |
met + [Nimet] - EO<< ЭО |
Vozlišča imajo katione in atome kovine. Klic se lahko prosto giblje v medvozličnem prostoru elektronike. |
|
∆c= EO1 - EO2 |
< 1,7 |
> 1,7 |
||
|
Prijavite se |
samo govori - nevrženi. |
kisline, oksidi |
soli, travniki, luža kovinski oksidi |
samo govori - metal. Zv'yazok v kovinah in zlitinah, ki vibrira zvočno močne elektrone med kovinskimi ioni v kovinskih kristalih. |
II. Bistvo kovalentne vezi
Kovalentna povezava - tse link'yazyk, scho vinikaє mіzh atomi za rahunnya zagalnyh elektronskih parov (na primer H2, HCl, H2O, O2).
Za stopnjo premika visokotonskih elektronskih parov na enega od atomov, ki jih povezujejo, so lahko kovalentne vezi polarnoі nepolarni.
III. Kovalentna nepolarna kemična vez
Kovalentna nepolarna vez (CNS) - utvoryuyut atomi enega in istega kemičnega elementa - nekovine(Na primer H2, O2, O3).
Komunikacijski mehanizem
Kožni atom nekovine je viden v globoki skorji drugega atoma zunanjega parjenja elektronov. Spletne stave so poravnane. Elektronski par je enak za oba atoma.
Oglejmo si mehanizem raztapljanja molekule klora: Cl2- kns.
Elektronska shema raztapljanja molekule Cl2:
Strukturna formula molekule Cl2:
Cl - Cl, σ (p - p) - ena povezava
Prikaz molekule raztopljene vode
Oglejmo si mehanizem nastanka kisle molekule: O2 - kns.
Elektronska shema eliminacije molekule O2:
Strukturna formula molekule O2:
O = O
π
Molekula ima večkratno, podzgibno povezavo:
ena σ (p - p)
tisti π (p - p)
Dokaz topnosti molekul kisika in dušika
IV. Zavdannya za pritrditev
Zavdanja št. 1. Ugotovite kemične vezi v molekulah napredujočih govorov:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Naloga št. 2. Napiši mehanizem raztapljanja molekul H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2. V primeru kovalentne vezi se določi vrsta elektronskega prekrivanja (π ali σ), pa tudi mehanizem nastanka (izmenjava ali darovalec-akceptor)
Pogledali smo že, kako atomi elementarnih kovin medsebojno delujejo z atomi elementarnih nekovin: nekateri dajejo svoje elektrone in se med seboj transformirajo na pozitivnih ione, drugi sprejemajo elektrone in se z drugimi transformirajo na negativne ione. Privlačijo se ena proti ena in zadovoljijo ionsko polovico.
In kako se razvija povezava med atomi elementov-nekovinov, kako lahko sledim trendu pred prihodom elektronov? Poglejte zadaj, kot da se tvori povezava med atomi istega kemičnega elementa, na primer v govoru, kjer lahko najdemo dvoatomske molekule: dušik N 2, voda H 2, klor C1 2.
Upoštevajte, da za izboljšanje skladišča teh govorov s pomočjo kemičnih znakov obstaja tudi nadomestni indeks.
Dva enaka atoma nekovinskega elementa se lahko združita v molekulo samo na en način: tako, da povežeta lastna elektrona in tako postaneta skupna za oba atoma.
Poglejmo si na primer raztopino molekule fluora F2.
Atomski fluor je element glavne podskupine VII skupine (skupina VIIA) periodnega sistema kemičnih elementov D.I. Mendeliev - delati na ravni energije, ki je enaka temu elektronu, in kožni atom ne doseže konca samo enega elektrona. Zunanji elektroni atoma fluora izpolnjujejo tri elektronske paritete in en neparen elektron:
Takoj, ko se dva atoma približata drug drugemu in v njihovi koži - eden za drugim neparni elektron, se qi elektroni "združijo" in postanejo svetli za oba atoma, v katerih nastanejo konci zunanje osemelektronske vrstice.
Raztopina molekule fluora je prikazana na diagramu:

Kako označiti elektronski par z rižem, ga zapišite kot strukturno formulo, na primer strukturno formulo molekule fluora
Podobno kot molekula fluora se dvoatomska molekula vode H 2 raztopi:

Nato dokončajmo, da bo vodni atom dvoelektronska črta, podobna zaključeni črti atoma helija.
Strukturna formula molekule vode
![]()
Pojasnimo naše ugotovitve o kovalentni vezi na podlagi raztopljene molekule vode, vikoristično razumevanje elektronskega mraka (razdelka § 9). Ko sta dva atoma blizu drug drugemu, ki imata sferično obliko, bo en oblak s-elektronov prekrival elektronski oblak. Ko krivite območje (misce), kjer je negativni naboj najvišji, zato se lahko negativni naboj premika. Pozitivno nabito jedro se pritegne k njemu (po tečaju fizike) in molekula se usede. V tem vrstnem redu je kemična povezava posledica dielektričnih sil. To lahko jasno vidite na diagramu:

Slid zaznachit, scho na osnovi osvetlitve kovalentne vezi, tako kot in v primeru okvarjene ionske vezi, ležijo v medsebojnem delovanju nasprotnih nabojev.
Na koncu si poglejmo še algoritem zrcaljenja, ki je potreben za zapis sheme osvetlitve kovalentne vezi, na primer za molekulo dušika N 2 .
1. Dušik je element glavne podskupine skupine V (skupina VA). Yogo atomi lahko pet elektronov na zunanji ravnini. Če želite določiti število neparnih elektronov, pospešite formulo:
8 - N = število nesparjenih elektronov,
de N je številka skupine kemičnih elementov.
Nato ima atom dušika (8-5 = 3) tri neparne elektrone.
2. Zapišimo znake kemičnih elementov iz znakov znanih elektronov tako, da se neparni elektroni pripeljejo do sodnega znaka:
![]()
3. Zapišimo elektronsko strukturno formulo molekule, ki je bila ugotovljena:
Če je atom med seboj vezan z enim samim elektronskim parom, se taka kovalentna vez imenuje enojna, če sta povezani dve, če je trojna, če je trojna.
Več kot je elektronskih parov v atomih molekule, bolj je smrad povezan eden z enim in manj stojiš med jedri atomov, kot pravijo dvojni člen. Za molekule fluora je povezava enojna, povezava med jedri atomov pa postane 0,14 nanometrov (1 nm = 10 -9 m ali 0,000000001 m). V molekulah dušika se povezava izgubi in dolžina yogo postane 0,11 nm. Da bi molekulo dušika razdelili na približno ducat atomov, jo je treba zmleti približno simkrat več energije nižje za razvoj enojnih vezi v molekuli fluora.
Ključne besede in besedne zveze
- Atomska ali kovalentna kemična vez.
- Posamezna, podvintage in izguba kovalentnih kemičnih vezi.
- Klic Dovžine.
- Elektronske strukturne formule.
Robot z računalnikom
- Vrnite se na elektronski program. Preberite gradivo za lekcijo in preberite navodila za nalogo.
- Poiščite e-poštne naslove v internetu, ki so lahko dopolnilni dzherelami, kakі rozkryvayut zmіst ključne besede in besedne zveze odstavka. Prosite učitelja, da vam pomaga pri pripravi nove lekcije – da izveste več o ključnih besedah in besednih zvezah v naslednjem odstavku.
Poizvedba in naloga
- Vsi elementi glavne podskupine VII skupine (skupina VIIA) periodnega sistema D. I. Mendeliev (podskupine fluora) naredijo preproste govore, ki so sestavljeni iz dvoatomskih molekul. Zapišite elektronsko shemo osvetlitve strukturne formule takšnih molekul, vikoristični kemijski znak za vso podskupino G (halogen).
- Zapišite sheme za vzpostavitev kemičnih vezi govorov, katerih skladišče je prikazano s formulama KC1 in C1 2.
- Koliko neparnih elektronov lahko atomi sirki? Kakšna povezava bo v molekulah S2? Zapišite shemo za vzpostavitev kemične vezi v molekulah S2.
- Založite po vrstnem redu povečanja količine kemične sestave govora s formulami S 2 , Cl 2 , N 2 in obkrožite pravilnost svoje odločitve. Kako spremenite dolžino povezave v molekulah vrstice, ki ste jo zložili?
- Razdelite govor v dve skupini glede na vrsto kemične vezi: N2, Li2O, KS1, O2, CaF2, H2.
Zadeva: Kovalentna nepolarna vez
Upravitelj:
Oblikujte trditev o kovalentni vezi, kovalentni nepolarni vezi;
Prikaži mehanizem vzpostavitve kovalentne nepolarne vezi;
Prodovzhit razvitok umіn analіzuvati, robiti vysnovki;
Vihovuvat kultura spіlkuvannya.
Motivacija in namen:
Zakaj dušik in voda obstajata v navidez dvoatomskih molekulah? V procesu rozmovi zdіysnyuєmo svіlne tsіlepokladannya, ki vyznaєmo temo lekcije.
Predstavitev novega gradiva:
Oglejmo si, kako se vzpostavi kemična vez v molekuliCl 2.
Atom klora se nahaja vVIIASkupina periodičnega sistema torej nima več kot enega elektrona za dokončanje na isti energijski ravni. Šest elektronskih enakovrednih stavi stavi in ena neujemanja. Dva atoma klora, kot en neparen elektron, se približata drug drugemu, elektroni se "združijo" in postanejo svetlejši od obeh atomov, zaključili bomo vrsto naše jate - osem elektronov. Nekaj elektronov lahko preprosto prepoznamo po rižu.
Zato je kovalentna vez, a atomska, ista kemična vez, ki je kriva za rezultat sprejemanja žarečih elektronskih parov.
Ta kemična vez je vzpostavljena med atomi ene in iste nekovine, z enako visoko tonsko elektronsko stavo, kot da bi se ustalila, ležita na obeh atomih v enakem svetu, na drugi strani pa tam ne bo odveč, brez nenegativnega naboja, ta kovalentna vez se imenuje nepolarna.
Podobno se raztopi molekula H 2. Vendar pa se atom pogosto nahaja vIAskupini, da ima kožni atom vode lahko samo en elektron in do konca stare raven energije Ne morem se nasititi samo enega elektrona (predvidevam, da je za atome, ki sta razcepljena z vodo in helijem, pomembno, da se dokončata, kot da sta na novem 2 elektrona). Kožni atom lahko vzame en elektron naenkrat, neparni elektroni pa se združijo in zadovoljijo nabit elektronski par, tako da lahko prepoznate, kako majhne so slike.
Poleg tega, ko sta dva atoma blizu drug drugemu, je lahko koža katerega koli od njiju eno s-elektronsko sferično obliko, opazimo prekrivanje teh elektronskih globul. Ko je območje vzpostavljeno, je negativni naboj velik, k njemu se pritegnejo pozitivno nabita jedra in vzpostavi se molekula.

Oglejmo si mehanizem nastanka velike zložljive molekule 2 .
Kisen je notriVIAskupina, otzhe, vіn lahko 6 elektronov na isti ravni. In za izračun števila neparnih elektronov lahko uporabite formulo 8 -N, deN- Številka skupine. Zato bosta v atomu kože po 2 neparna elektrona, ki bosta sodelovala pri vzpostavljeni kemični vezi. Dva neparna elektrona se združita z dvema drugim neparnim elektronoma drugega atoma in nastaneta dve veliki elektronski stavi, ki si jih lahko miselno predstavljate, ko pogledate dve figi.
Delci členov v molekuli kisline so sestavljeni iz dveh elektronskih parov, ki ju imenujemo podzemna železnica, eden bo večji, spodnji bo enojni, kot molekula vode. Ale zahteva razumevanje, kakšna je najmanjša povezava med atomi v molekuli, manjša je razdalja med jedri atomov. Tsya vіdstan se imenuje stari zv'yazku. Tretja povezava je še vedno kratka za spodnji del, ale richly mіtsnіshiy. Na primer, v molekuli dušika pride do izgube povezave, da bi molekulo razdelili na dva atoma, je treba porabiti veliko več energije, nižje, da bi prekinili eno samo vez v molekuli klora.
Uzagalnennya, da je sistematizacija znanja:
Katera kemična vez se imenuje kovalentna?
Med atomi katerih elementov so vzpostavljene kovalentne nepolarne vezi?
Kaj je bistvo vzpostavitve kovalentne vezi?
Zakaj se en sam zv'yazok konča v obliki visečega in visečega?
Kaj ti bo pokazalo povezavo in kaj je smisel lagati?
Konsolidirano kontrolno znanje:
Sestavite sheme za raztapljanje govornih molekul: a) brom; b) fluor; c) dušik.
Izklopite linijo kože:
a) CO 2 , NH 3 , P 4 , P 2 O 5 ;
b)Cl 2 , S, N 2 , CO 2 .
predlog:
a)P 4 ; b)Cl 2 , S, N 2 . Cerebro s kovalentno nepolarno vezjo.
Izberite govore s kovalentno nepolarno vezjo:
P 4 , H 2 S, NH 3 , P 2 O 3 , S, N 2 , O 2 , H 2 O, HCl, H 2 .
predlog: govora s kovalentno nepolarno viskozno raztopino istih atomov nekovin, to boP 4 , S, N 2 , O 2 , H 2 .
Odsev in pidbitya pidsumkiv:
Kako vam je mar, kako je snov za pouk obvladana? dober; b) dobro; c) precej; d) ni pridobljeno.
Ali mi lahko takoj poveš o hrani, kot da smo jo dali na storž lekcije?
Domače naloge:
jazrіven: §11, npr. trinajst;
IIrіven: tezh + ex. 4, 5.