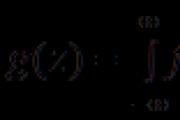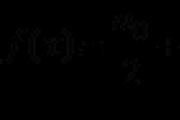Zapremina plavih gasova u hemijskim reakcijama. Avogadrov zakon
Tabor govora sličan gasu. Avogadrov zakon. Molarna zapremina gasa.
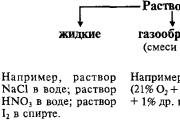
Govor se može reciklirati u tri mlina agregata - čvrsti, rijetki i plinoviti. Čestice su, u tom broju, sastavljene od tvrdog govora, da bi među sobom napravile mitzno pov'yazan, tom tvrdom govoru čine jedinstvenu formu. Dijelovi čvrstih tijela mogu biti atomi, molekuli, ioni, koji čine kristalne strukture. Qi chastki kolivayutsya s malom amplitudom otkucaja vuzlív kristalnog 'rata. U domorodačkim regijama, dijelovi su vezani jedan prema jedan slabije i mogu se previše oblačiti kako bi se napravila velika razlika. Iz tog razloga, plinnist i naduti forme sudija, u kojima je smrad poznat.
Prijelaz govora iz čvrstog tijela rijetko se uočava tijekom zagrijavanja, zbog čega se amplituda cijepanja čestica postepeno povećava. Kada je temperatura visoka, čestice govora nabubre sa zdatnošću, preplavljuju čvorove brazde, uočava se topljenje. Kada se ohlade, navpaki, dijelovi rídini provode zdatníst pokret i fiksiranje u položaju za pjevanje, čineći govor čvrstim. Za najveće umove, rídini, po pravilu, muče molekularni život. Na visokim temperaturama, struktura rídinija može biti različita (taljenje soli i metala).
Interakcije između molekula bogato slabe, niže između jona u ionskim kristalnim strukturama; atomi vezani kovalentnom vezom u atomskim strukturama; metalni joni, vezani elektronskim gasom u metalnim strukturama.
Čvrst i rijedak tabor govora za stvaranje hrabrog imena kondenzacioni mlin. Debljina govora u kondenziranom čeliku mijenja se na granicama od približno 0,5 - 22,5 g / cm 3. Govor na benzinskoj stanici može imati znatno manju debljinu - blizu 10 -2 - 10 -3 g / cm 3. Prijelaz na plinovitom mlinu je uzrokovan zagrijavanjem govora koji se nalaze u kondenziranom mlinu (ključanje čvrstih tvari, sublimacija tvrdih govora). Nalik plinu za najveće umove govora sastoje se od molekula.
Prilikom prelaska u plinovito stanje, čestice govora dodaju sile međumolekularne interakcije. Obsyag, koji zauzima plin, koji, u stvari, zaklanja slobodan prostor između molekula plina, koji se nasumično kolabiraju. Veličina ovog prostora određena je temperaturom i porokom. Kada smo obsyagom, okupirani samim molekulima, možemo se pobuniti. zvezde vrište Avogadrov zakon :
Jednake obaveze različitih gasova imaju isti broj molekula za iste umove.
Iz zakona Avogadrova vika dva glavna nalaza .
Prva posledica
Jedan mol bilo koje vrste gasa za iste umove posuđuje isto zalog. Tsey obsyag se zove molarni pritisak gasa ( V m ) , Što se vimiruje u m 3 / mol (često u dm 3 / mol). Molarna obaveza prema gasu je naprednija da bi se gas obavezao na istu količinu:
Vídomo, scho vrijednost V m pasti u víd umove (temperatura, tysk). Da biste izvršili zadatak, potrebno je zapamtiti vrijednost V m at normalni umovi (n.o.s.) - atmosferski pritisak (101,3 kPa) i temperatura leda (0 0 C ili 273,15 K).
Za normalne umove V m \u003d 22,4 dm 3 / mol, ili
u CI jedinicama 0,0224 m 3 / mol.
Još jedna posljedica
Širina gasova (ili mase istih gasova) se sastavljaju kao molarne mase gasova.
To se vidi iz takvih ogledala. Donesite dvije porcije različitih plinova iste obaveze (obaveze vimirijana za iste umove). Znamo ih:
Postavljanje njihove mase:
Yakshcho vikoristovuvat schílníst:
Iza Avogadrovog zakona n 1 = n 2, pogledajte:
Promena debljine gasova, koja je skuplja u promeni molarne mase, naziva se nosivost jednog gasa u drugom ( D ). D - vrijednost je nedefinirana.
Poznavajući D i molarnu masu jednog gasa, lako je znati molarnu masu drugog gasa:
; M1 = M2 × D.
primijeniti
M(x) = M(H2) × D=2 × 8,5 = 17 g/mol
Plin iz takve molarne mase - amonijak NH 3 .
Pokazaće se da je jačina određenog gasovitog ugljenog hidrata skuplja za dvoje. Promijenite svoju molarnu masu u ugljikohidrat.
Čini se da je prosječna molarna masa 29 g/mol.
M(x) = M(p.) × D=29 × 2 = 58 g/mol
Ugljikohidrat s takvom molarnom masom je Z 4 H 10 butan.
Imajte na umu da su plinovi s molarnom masom manjom od 29 laki po ponavljanju, a više od 29 su važni.
U rozrahunkovyh biljkama mogu postojati podaci o dušiku, kiselosti i drugim plinovima. U ovom slučaju, za vrijednost molarne mase potrebno je viskoznu debljinu pomnožiti sa molarnom masom, slično dušiku (28 g/mol), kiselom (32 g/mol) itd.
Avogadrov zakon se široko koristi u hemijskim studijama. Oskílki za gasove su proporcionalni broju govora, zatim koeficijenti u jednakim reakcijama, koji odražavaju broj reagujućih govora, proporcionalni proporcijama gasova koji ometaju. Očigledno, scho obsyagi mayut, ali vimiryan za iste umove.
guza
Za lomljenje od 2 dm trebat će neka vrsta kiselog 3 propan? Vymiryan obyagi za n. y.
H 3 H 8 + 5O 2 3CO 2 + 4H 2 O.
Iz Avogadrovog zakona jasno je da bi jednak broj različitih plinova trebao biti jednak istom broju molekula i, očito, istom broju molova govora. Podignimo propan do 1 dm3. Todi, iz jednake reakcije, za opekotine 1 dm 3 propana potrebno je 5 dm 3 kiselog, a 2 dm 3 (dva litra) - 10 dm 3 Pro 2.
hemija
Globalna hemija
Osnovni pojmovi, zakoni i teorije hemije
Zapremina plavih gasova u hemijskim reakcijama. Avogadrov zakon
Gay-Lussacov zakon novca
Gazije reaguju jedni na druge na pjesme opšteg govora. Godine 1808. str. J. L. Gay-Lussac je uspostavio sljedeće pravilo: Količina plinova koji ulaze u reakciju može se vidjeti jedan prema jednom od onih plinovitih proizvoda u reakciji, kao mali brojevi.
Vídkritiy vchenim zakon vídomy u hemiji jak zakon volumena b. Za jogu je neophodno da se gasovi koji učestvuju u reakciji održavaju na istoj temperaturi i pritisku.
Vídnoshennya obsyagív gazív, scho za ulazak u hemijsku reakciju, vídpovídat koeficijenti jednaki, na primjer: .
U ovom slučaju 3 zapremine vode reaguju sa 1 zapreminom azota, usled čega se rastvore 2 zapremine amonijaka, tako da se pokazuje spontanost.
Menadžer. Koja je potrebna reakcija vode za 2 m 3 dušika?
Rješenje
Iz jednake reakcije se vidi da je zapremina vode kriva ali 3 puta veća za zapreminu azota:
obsyag vode m3.
Avogadrov zakon
Za objašnjenje jednostavnog spívvídnoshení mízh vzyagyah reagujućih plinova vikoristovuyut Avogadroov zakon: Jednake veze različitih gasova za iste umove (temperatura i pritisak) imaju isti broj molekula.Nisam dozvolio da Avogadrov zakon zacvili dva puta ta:
1) Jedan mol bilo koje vrste gasa za iste umove posuđuje istu obavezu.
Za normalne umove (n.a.), tada na temperaturi od 273 K i vice 101,3 kPa (1 atm), 1 mol bilo kojeg plina zauzima zapreminu, jednaku 22,4 litara. Tsei obsyag poziv molarni gas i označava l/mol.
Molarna veza se može popustiti formulom
.
2) Sa konstantnim pritiskom, ta temperatura gasnog jaza je manja od jedne molarne mase.
To vam dozvoljava da pogrešno shvatite propusna debljina prvi gas na drugi način:
,
de D- vidno šilnista, kako pokazuje, u isto vreme prvi gas je važan za drugi za iste umove.
Vikorist je najčešće u stanju da vidi vodu kroz gas. Todi:
; .
Moguće je popustiti gusto gusto za bilo koji gas.
Čija distribucija vikoristan materijala metodički asistent"Navchannya rozvyazannyu problemi hemije". Autori - administratori: nastavnik hemije najviše kategorije, metodičar Zavoda za obrazovanje "Gimnazija br. 1 grada Grodna" Tolkach L.Ya.; metodičar početno-metodičkog odjela Zavoda za školstvo "Grodno OIPK i PRR i SV" Korobova N.P.
Proračun broja molarnih zapremina gasova.
Proračun izražene gustine gasova.
Zapremina plavih gasova
Jedan mol bilo koje vrste gasa za iste umove zauzima isti. Dakle, za normalne umove (n.o.),tobto. na temperaturi od 0 °S i normalan atmosferski pritisak, koji iznosi 101,3 kPa, jedan mol bilo kog gasa zauzima zapreminu22,4 dm3.
PodešavanjeJa obavezujem gas na određenu hemijsku količinu govora - vrednost, kako se to zovemolarni pritisak gasa (Vm):
Vm = V/ ndm 3, zvjezdiceV = Vm · n
Da bismo odabrali: najlakši ili najvažniji plin jednak je drugom plinu, dovoljno je izjednačiti njihovu debljinu:
r 1 / r 2 = M 1 V 1 / M 2 V 2 = M 1 / M 2 = D 2.Sa stanovišta indukovanog viraza, jasno je: izjednačiti širinu gasova, postići izjednačavanje njihovih molarnih masa.
Odnos molarne mase jednog gasa i molarne mase drugog gasa je vrednost, kako se zove
primetan prostor ( D 2 ) jedan gas sa drugim gasom.Znajući jačinu jednog plina u drugom, možete izračunati molarnu masu:
M
1 = M 2 · D 2 .Ako vidite zbir gasova, onda je ova "molarna masa" jednaka masi zapremine 22,4 litara. Tsya vrijednost je numerički naprednija:
M pov. = 29 g/mol
Očigledno, do Avogadrova zakona, isti broj molekula različitih plinova za same mirne umove uzima istu količinu.
Iz ovoga je evidentna još jedna posljedica.
Pri konstantnoj temperaturi i pritisku, gasovi počinju da reaguju jedan prema jedan, a takođe i do stepena gasovitih produkata, koji se talože, kao mali brojevi.
Ovaj zakon je Gay-Lussac formulisao kao zakon zapremine gasova. Na ovaj način, ako hemijska reakcija uzme svoj udio, ili izađe govor poput gasa, onda je za jednake reakcije moguće ugraditi količine plave boje.
Obsyagi gasovi, na koje reaguju, proporcionalni su hemijskim količinama ovih govora:
V 1 / V 2 = n 1 / n 2 tobto. V 1 i V 2
brojčano jednaki koeficijenti jednakih reakcija.primjer 1. Balon drži 0,5 kg iscijeđene vode. Kakav volumenposuditi tako veliku količinu vode? oprati normalno.
Rješenje:
1. Izračunajte hemijsku količinu
voda, šta se osvetiti u balonu:N
(H 2) = 500/2 \u003d 250 (mol), de M (H 2) = 2 g / mol.2.Oskílki za normalne umove 1 mol bilo kojeg plina traje ukupno 22,4
dm 3, dakleV = Vm · n, V( H 2 ) = 22,4 * 250 = 5600 (dm 3)
Vidpovid: 5600 dm 3
Butt2. Koje skladište (u %) aluminijum-mid legure, kao pri ispitivanju 1 g viška joda hlorovodonične kiseline, uočeno je 1,18 l voda?
Rješenje:
1. Tada samo aluminijum može ući u reakciju sa kiselinomnapiši jednako:
2A1 + 6HC1 = 2A1C1 3 + 3H 2
2mol 3mol
2. Izračunljivo hemijska količina voda:
n(H 2 ) = 1,18/22,4 = 0,05 (mol)
3. Na osnovu reakcije izračunavamo masu aluminijuma,šta sakriti u leguri:
3 mol 2 mol aluminijum
0,05 mol da vidi vodu, kao da reagujexmol aluminijum
x = 0,05 2/3 \u003d 0,033 (mol),
m( Al) = 0,035 27 = 0,9 (g), de M(Al) = 27 g/mol
5. Izračunljivo maseni udio aluminijuma u metalu:
w(ALIl) = m ( Al ) / m (legura) , w( A1) = 0,9/1 = 0,9 chi 90%.
Todi maseni udio midi legure 10%
Tip: 90% aluminijum, 10% midi
primjer 3. Značajno prepoznatljiva snaga: a) Ponovit ću to,b) voda sa ugljen-dioksidom.
Rješenje:
1. Poznato je da vidite kiselost kiselog kada ga pogledate:
D povit (Pro 2) =M(Pro 2)/M (pov.) = 32/29= 1,1.
2. Možemo vidjeti prisustvo ugljičnog dioksida po vode
D H2 (CO 2) =M(Z 2 )/M(H 2) \u003d 44/2 \u003d 22.
Vidpovid: 1,1; 22
guza 4. Odredite zapreminu gasova koji dodaju do 0,5 mola kiselog, 0,5 mola vodei 0,5 mola ugljičnog dioksida.
Rješenje:
1. Znamo hemijsku količinu zbira gasova:
n(sumish) \u003d 0,5 + 0,5 + 0,5 \u003d 1,5 (mol).
2. Izračunajte ukupnu količinu gasova:
V(sumish) \u003d 22,4 1,5 \u003d 33,6 (dm 3).
Širina: 33,6 dm 3 suma
Primjer 5. Izračunajte volumen ugljičnog dioksida koji se emituje pri pljuvanju 11,2 m 3 metan CH 4 .
Rješenje:
1. Zapišite hemijsku reakciju sagorevanja metana:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
1 krtica1 krtica
1 m 3 1 m 3
2. Da bismo izračunali količinu ugljičnog dioksida, zbrajamo i mijenjamo proporciju:
kada spava 1 m 3 CH 4 weide 1 m 3 2
kada spava 11,2 m 3 CH 4 viide x m 3 2
x = 11,2 1/1 = 11,2 (m 3)
Vidpovid: 11,2 m 3 ugljen-dioksid
Primjer 6. Čelični cilindar za sakupljanje stisnutih gasova napunjen je rijetkom kiselom masom od 8 kg.
Koji je obsyag posudio plin iz benzinske stanice (n.o.)?
Rješenje:
1. Izračunajte hemijsku količinu rijetkog kiselog:
n( O 2 ) = 8000/32 = 250 (mol).
2. Proračun kiseline slične plinu:
V( O 2 ) = 22, 4 250 \u003d 5600 dm 3.
Vidpovid: 5600 dm 3
Primjer 7. Izračunajte masu zapreminom od 1 m 3 (n.o.), što je 78 zapremina azota, 21 - kiselog, 1 - argona (krim drugih gasova).
Rješenje:
1. Vyhodyachi z zavdannya, obsyagi gazív vítrí vídpovídno dorovnyuyut:
V( N 2 ) = 1 0,78 = 0,78 m 3;
V(Pro 2) \u003d 1 0,21 \u003d 0,21 m 3
V(ALIr) = 1 0,01 = 0,01 m 3.
2. Izračunajte hemijsku količinu kožnog gasa:
n( N 2 ) = 0,78 / 22,4 10 -3 \u003d 34,8 (mol),
n(Pro 2) \u003d 0,21 / 22,4 10 -3 \u003d 9,4 (mol),
n(ALIr) \u003d 0,01 / 22,4 10 -3 = 0,45 (mol).
3. Izračunajte masu gasova:
m(N 2 ) = 34,8 28 = 974 (g),
m(Pro 2 ) = 9,4 32 = 30 (g),
m(ALIr) = 0,45 40 = 18 (d).
4. Izračunajte masu svaki put:
m(Ponavljanje) \u003d 974 + 301 + 18 \u003d 1293 (g) ili 1,293 kg.
Težina: 1.293 kg dnevno
Primjer 8. Kada podpalyuvanni u evdiometriju sumish kiseli i vode sa zapreminom od 0,1 m 3 ukupna suma promijenjena za 0,09 m 3 .
Yaki obećavavoda i kiselo su bili na izlazu sumishi, kao gas, sta je ostalo, gori (n.o.)?
Rješenje:
1. Zapišite jednaku reakciju:
2H 2 + Pro 2 = 2H 2 Pro
2 mol 1mol 2mol
2. Očigledno je da su gasovi koji su ušli u reakciju.
počinio vreća za plin je pojurila za rahunkom slatke vode, do koje su gasovi koji su ušli u reakciju dostigli 0,09 m 3 .
Jer gasi ući u reakciju brzinom od 2:1, zatim sa 0,09 m 3 dva dela
padne na vodu, a jedan - na poljupcu. Oče, reaguj
ušao 0,06 m 3 vode i 0,03 m 3 kiselo.
3. Izračunajte količinu gasa u ukupnoj količini.
Jer plin, ako se prelije, gori, onda je cijeli dan 0,01 m 3 .
V(H 2 ) = 0,01 + 0,06 = 0,07 (m 3 ) ili 70 l,
V(Pro 2 ) = 0,1 - 0,07 = 0,03 (m 3 ) ili 30 l.
Preporuka: 70 litara vode, 30 litara kisele
Primjer 9. Koja je razlika između količine vode u gasnoj mešavini kojoj se dodaje do 56 litara argona i 28 litara azota (n.o.)?
Rješenje:
1. Vyhodyachi z vyznachennya vídnoí̈ gustina gazív,
D H 2 = M (lud) / M(H 2 ).
2. Izračunajte hemijsku količinu i težinu zbira gasova:
n(Ar) = 5,6/22,4 = 2,5 (mol);
n(N 2 ) = 28/22,4 = 1,25 (mol);
n(sumish) \u003d 2,5 + 1,25 \u003d 3,75 (mol).
m(Ar) = 2,5 40 = 100 (g),
m(N 2 ) = 1,25 28 = 35 (g),
m(sumish) \u003d 100 + 35 \u003d 135 (g), jer
M(Ar) = 40 g/mol, M (N 2 ) = 28 g/mol.
3. Izračunajte zbroj molarne mase:
M(sumish) = m (lud) / n (lud) ;
M (sumish) \u003d 135 / 3,75 \u003d 36 (g / mol)
4. Izračunajte ukupnu količinu gasa u vodi:
D H 2 = 36/2 = 18.
Datum: 18
guza 10. Možete li zapaliti 3 g drvenog vugill-a na trolitarski bantz, punjen kiselim (n.o.)?
Rješenje:
1. Zapišite jednaku reakciju planinskog vugila:
W + Pro 2 = SO 2
1mol 1mol
2. Izračunajte hemijsku količinu vugill:
n(SA) = 3/12 = 0,25 (mol), tako da M (C) = 12 g / mol.
Hemijska količina kiselog, neophodna za reakciju, takođe će biti jednaka 0,25 mol
3. Izračunajte količinu kiselosti koja je potrebna za lomljenje 3 g votke:
V(O 2 ) = 0,25 22.4 = 5,6(l).
4. Oskílki plin posuđuje volumen posude, u istom vinu je poznato, ê 3 litre kiseline. Otzhe, nemoj zašiti kilkos za spalyuvannya 3 g vugillya.
Savjet: nemojte šivati
guza 11. Da li koliko puta povećati zapreminu rijetkih voda u budućnosti transformacije u par na n.s.?
Za hemijske reakcije aA + bB = cC + dD
buditi se
de nA i nB su broj slobodnih govora koji su reagovali, ps i nD su broj proizvoda koji su rastvoreni, a, b, c i d su stehiometrijski koeficijenti.
Od broja govora, lako se ide na njihovu misu:
Za govore poput gasa, češće je postaviti chi da označi njihove obaveze. Ako su reagens i proizvod D plinovi, izvršite prijelaz s broja kostiju ovih govora na njihov:
![]()
Za vídomih (po umu) količinu, masi ili oblige (za gas) jednog od govora koji učestvuju u reakciji, moguće je izvesti vrijednosti svih veličina za druge govore.
Kod različitih suma gasova A i B, od kojih jedan učestvuje u reakciji, možete znati sp_v_dnoshnenja í̈kh obsyagív VA: VB, a za dati sp_vv_dnoshní - í̈kh obsyag sumíshi (ili navpaki).
Zadaci rozvyazannya zadnjice
Na visokoj temperaturi magnezijum reaguje sa azotom, pogledajmo zbir argona, ukupne zapremine 5,6 l (n.o.) i dodamo 15 g nitrida. Izračunajte zapreminu gasova V(N2): V(Ar) na izlaznoj sumi.


Zadatak za nezavisno rešenje dio A
1. 6 l dušikovog oksida (II) reagiralo je sa 5 l kiselog
2. U zatvorenoj posudi spaljeno je 24 g grafita u 67,2 l (n.a.) kiselog, a zapremina kiselog je uklonjena: proizvod je jednak
3. Kroz ozonator je propušteno 7,5 mol kiselosti, koja se često pretvarala u ozon. Preostalo nakon bojenja za „soljenje“ (za normalne umove) 0,5 mola vode iz krvi (vraćanje u SO2); kasnije je volumen O3:O2 na izlazu iz ozonizatora postao
4. Kalijum bromid mase 142,8 g, nakon što je malo reagovao sa hlorom, uzimaćemo ga u istoj količini ponavljanja u zapreminskom omjeru 1 (hlor): 2 (ponoviti). Galny obsyag (u litrima)
5. Za potpuno sagorevanje 17,92 l (n.o.) sumiša CH4 + H2 bio je potreban 1 mol kiselog. Na kraju dana ukupna količina CH4:H2 je izraženija:
6. Gas A, prilikom prženja 0,04 mol KClO3 na katalizatoru, skinuli smo (na n.a.) posudu sa gasom B, što se videlo kada smo testirali 6 g kalcijuma sa vodom, i oduzeli zbir zapremina A: B , jednako
7. Nakon ispljuvanja nitrobenzena u višku kiselosti zbira proizvoda (azot, ugljični dioksid, voda), u kojoj je uklonjeno 4 litre (n.a.) dušika, a volumen N2:O2 je veći od 4:1. u litrima , n . u.) postaje kiselo
8. Sprovedena termička razgradnja 1 mol amonijum hlorida u čeličnom balonu, koji je sadržavao i 11,2 l (n.a.) amonijaka. Kíntseve ob'êmne vídnoshennia NH3: NCl dorovnyuê
9. Sumish kiselo i hlor sa zapreminom 9:1 vikoristan za gledanje 0,5 mol jednostavnog govora sa rasponom KI
10. Kissen je propušten kroz ozonator, kada se 1 mol KClO3 prži na katalizatoru, kada se ispeče 5% kiselog, kiselo se pretvara u ozon i na izlazu iz ozonatora se smanjuje zapremina O2:O3
Fizičko-hemijske zakonitosti presovanja tankotopljenih metal-polimer sistema iz gasne faze
Tanko topljeni metal-polimerni materijali (metalni polimeri, metalne ploče sa tankim polimernim premazima, bogati kuglični sistemi, itd.), koji se oblikuju vakuumskom tehnologijom.
Epitaksijalni rast Ge na Si(100) površinama
Iz fizike tankih mrlja moguće je doći do perspektive daljeg razvoja mikroelektronike, optike i drugih primjena nove tehnologije. Uspjesi mikrominiranja elektronskih...
Komponente koje mogu biti moćne i smanjuju zapaljivost polimernih materijala
Nedugo kasnije, ekonomija zemlje će biti spašena od stotina miliona rubalja. Pri spaljivanju polimernih materijala to se vidi veliki broj otrovni gasovi koji su štetni za ljude i...
Ciljevi lekcije:
Pregledajte umjesto dokumenta
„Čas hemije 9 Zapremine plavih gasova u hemijskim reakcijama. Proračun ukupne potrošnje gasova za hemijske jednakosti.
Čas hemije na temu „Zapremina plavih gasova u hemijskim reakcijama. Proračun ukupne potrošnje gasova za hemijske jednakosti"
Lekcija #3 o tehnici kritičke misli
Ciljevi lekcije: formirati znanje o zakonu zapremine vode za gasoviti govor iz sučelja hemijskih reakcija organskog govora; formiraju zakon o'mnih spívvídnoshen za rozrahunkív íz khímíchnyh rivnyan. Dodoskonaljuvati vminnya uchnív viríshuvati rozrakhunkoví zavdannya shdo rívnyan khímíchnih reaktsíy. Razviti vmínnya uchnív skladište khímíchí zavdannya. Razvijajte kritičko mišljenje. Formirajte pozitivnu postavku dok objekt ne završi, zbir postavke prije kraja zadatka.
vlasništvo: kartice zadataka.
Sakrivena lekcija.
I.Zagrijavanje(Učenici se gube u svojim mislima)
A. Frans “Ako čovjek razmišlja, neće biti sumnivan, ali neće biti oduševljen, ako…”
Kako ste završili ovu frazu?
Naučite vježbati u grupama. Zapišite predložene opcije. Odaberite tí, yakí na í̈hnyu dumku stane više.
Visnovok: „Ako čovjek misli, neće se zbuniti, ali neće ni pjevati, ako jeste.“
I spodívayus, scho na desnoj strani, kojom smo zauzeti na lekciji, da vas udarim i pokazat ćete svoju živahnost u sadašnjosti.
II. Motivacija za aktivnost učenja.
Zapanjen onima koji su vodili lekciju.
S. Koraci ažuriranja
Iza dijagrama V_den pogodite hemijsku snagu alkenív i alkínív.
Zašto te briga molarna kontrakcija god gas za n.s.
prijedlog: 22,4 l/mol
Kako je formulisan Avogadrov zakon?
prijedlog: Na istim obavezama različitih gasova, za iste umove (t, p), osveti se isti broj molekula.
Visnovok: Količine gasovitih reagenasa i produkta reakcije su koordinirane kako su njihovi koeficijenti u reakciji jednaki. Tsya zakonírníst vikoristovuêtsya za khímíchnyh rozrahunkív.
Kreativni zadatak:(Pruža vam priliku da ponovo razmislite sa jakim znanjem naučnika o ovoj temi)
U tri numerisane epruvete, zatvorene čepovima, ê: metan, etilen, acetilen. Kako prepoznati, gdje je plin poznat?
IV. Koraci obavještavanja(Dovođenje do znanja gradiva koje se zasniva na problemima, traganje za istinom).
Predavanje („Vrtuljak“ je ojačano: osnovno razumevanje kako se dan venčanja daje na početku; nakon završetka se studenti udružuju u opkladu, dobijaju slične zadatke; sastavljaju slične zadatke, kao sudski dan itd. .)
Zapremina hlora (n.o.) za reakciju sa 7 litara propena je:
a) 14 l; b) 10 l; c) 7 l; d) 22,4 litara.
3. Izračunajte ukupan iznos novca koji vam je potreban za lomljenje sumishija,
dodaje se do 5 l etilena i 7 l acetilena (n.o.).
Molimo navedite kolika je količina vode potrebna za potpunu hidrolizu 7 litara etilena, dok reakcija ne bude jednaka:
Z 2 H 4 + H 2 \u003d Z 2 H 6 a) 7 l; b) 6 l; c) 14 l; d) 3,5 litara.
Parovi rade. Učenici, ujedinjeni u opkladi, sastavljaju slične naredbe, kao par virishu sudidnya:
Količina vode potrebna za potpuno zalivanje je 15 litara butina, više: a) 15 litara; b) 30 l; c) 7,5 l; d) 3,5 litara.
Bilo koji volumen klora se dodaje u 5 l acetilena, ovisno o reakciji C 2 H 2 + 2Cl 2 = C 2 H 2 Cl 2
a) 5 l; b) 10 l; c) 2,5 l; d) 22,4 litara.
3. Izračunajte ukupne troškove, jer je potrebno potrošiti na štednju
10 m3 acetilena (N.O.).
V. Refleksija
Vikonannya zadatak s kartice.
Izračunajte ukupnu količinu vode, potrebu za ponovljenim zalivanjem govora X.
(Nauče samostalno popunjavati tabelu, po završetku rada odgovaraće na pitanja).
| Obsyag govor X, l | Formula govora X | Rivnyannya gidrovania | voda, l |
|
VІ . Visnovki sa lekcije
Formuliran je zadatak nadolazeće lekcije.
VІ I. Torbice za lekciju
VIII. Zadaća
Propratsiuvati paragraf 23, vikonati desno 206, 207 sa strane.