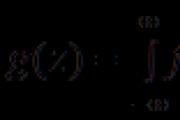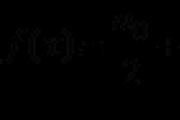About'êmni vídníní gazív u kemijskim reakcijama. Avogadrov zakon
Mlin na plin Rechovin. Avogadrov zakon. Molarni volumen plina.
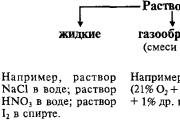
Zapisi se mogu obnoviti u tri mlina agregata - čvrsti, tvrdi i plinoviti. Čestice se, osim toga, pohranjuju u čvrste riječi, da bi završile motično vezane između sebe, odnosno riječi su čvrste u obliku jednine. Čestice čvrstih čestica mogu biti atomi, molekule i mogu stvarati kristalne strukture. Dosta je dijelova sklono maloj amplitudi za sveučilišta kristalnih krata. Na dnu čestice jedna je povezana s jednom slabijom i može biti prezasićena kako bi se postigla velika raznolikost. Na to mogu vidjeti boru i nabubriti oblik suca, u takvom smradu koji se može naći.
Prijelaz govora iz čvrste strofe rídke se može vidjeti kada se zagrije, zbog čega amplituda broja čestica postupno raste. Na istoj temperaturi čestice rijeke se pune zgradama, što je zrno veće, dodaje se otopljeno. Kad je hladno, navpaki, čestice crte preuzimaju snagu promjene i fiksiraju se u položaj za pjevanje, uspostavljajući čvrst govor. Za zle umove Ridina, u pravilu, kažu molekularne bube. Pri visokim temperaturama može se koristiti struktura linije (taljenje soli i metala).
Vzaêmodiya između molekula nagato slaba, manje iona u ionskim kristalnim strukturama; atomi povezani kovalentnom vezom u atomskim strukturama; metalni ioni, vezani s elektronskim plinom na metalnim strukturama.
Nazvat ću težak i dosadan tabor govora kondenzacijski mlin... Čilnosti rijeka u kondenziranom mlinu su oko 0,5-22,5 g/cm 3 na granicama. Riječi u plinastom mlinu su znatno manje učinkovite - blizu 10 –2 – 10 –3 g/cm 3. Prijelaz s mlina na plin rezultirat će zagrijavanjem komora, koje se nalazi u kondenziranom mlinu (sublimacija čvrstih mlina). Govor poput plina za zle umove sastoji se od molekula.
Tijekom prijelaza u mlin nalik plinu, čestice govora zbrajaju snagu međumolekularne interakcije. Obsyag, koji posuđuje plin, je, prema danu, obsyag vilny prostor između molekula plina, pa će se kaotično srušiti. Veličina prostora počinje s temperaturom i porokom. Uz puno novca, brinemo se o samim molekulama, možemo se izvući. zvidsey viplya Avogadrov zakon :
Za iste umove, isti broj molekula će se osvetiti za iste umove.
Iz Avogadrova zakona dva glavna traga .
Prvo Slidstvo
Jedan mol plina za iste umove, posuđivanje istog obsyaga. Tsey obsyag biti pozvan molarnim plinom ( V m ) , Ona varira u m 3 / mol (djelomično u dm 3 / mol). Molyarny opskrba plinom za opskrbu plinom prije prošle godine:
Čini se da je vrijednost V m taložena iz umova (temperatura, porok). Za reviziju postrojenja potrebno je zapamtiti vrijednost V m at normalni umovi (n.o.) - atmosferski porok (101,3 kPa) i temperatura leda (0 0 C ili 273,15 K).
Za normalne sudopere V m = 22,4 dm 3 / mol, abo
u jedinicama SÍ 0,0224 m 3 / mol.
Još jedan uspjeh
Šilnosti plinova (za većinu istih obveza) postavljaju se između sebe kao molarna masa plinova.
Tse se vidi iz takvog mirkuvana. Nekhai dvije porcije mladih plinova istog obsyagua (obsyagi vimiryana za iste umove). Znamo ih masi:
Pokrov njihove mase:
Koliko je pobjednički?
Iza Avogadrova zakona n 1 = n 2, zvijezde:
Isporuka zaliha plina s kapacitetom jednog plina u smislu ( D ). D - vrijednost je bezdimenzionalna.
Poznavajući D i molarnu masu jednog plina, lako je znati molarnu masu jednog plina:
; M 1 = M 2 × D.
staviti na
M (x) = M (H2) × D = 2 × 8,5 = 17 g/mol
Plin iz takve molarne mase - amiak NH 3 .
Snaga plinovitog u ugljikohidratu od dvije osobe. Uzmite molarnu masu u ugljikohidratima.
Prosječna molarna masa je 29 g/mol.
M (x) = M (pov.) × D = 29 × 2 = 58 g/mol
Ugljikohidrat s takvom molarnom masom je Z 4 H 10 butan.
Slajd znači da je plin s molarnom masom manjom od 29 nogu po piću, više od 29 - važno.
Rosrakhunkov poduzeća mogu imati danak dušiku, kiselosti i plinu. Općenito, za vrijednost molarne mase potrebno je pomnožiti količinu gustoće s molarnom masom na bazi dušika (28 g/mol), kiselog (32 g/mol) itd.
Avogadrov zakon se široko koristi među kemičarima. Oscilacije za plinove proporcionalne su broju pretvorbi, zatim učinku u učinkovitoj reakciji, što pokazuje broj reaktanata, proporcionalan broju konvertibilnih plinova. Očito, u redu je biti vimirovci za iste umove.
guzicom
Yakiy obsyag kisnyu će biti potreban za spavanje 2 dm 3 propan? Obveze vimiryani za n. na.
Z 3 N 8 + 5O 2 3SO 2 + 4N 2 O.
Prema Avogadrovom zakonu, isti broj molekula trebao bi biti zamijenjen istim brojem molekula i, po svemu sudeći, istim brojem moljaca rechovina. Uzmite propan za 1 dm3. Todi, uz razumnu reakciju, za 1 dm 3 propana potrebno je 5 dm 3 kiseline, a 2 dm 3 (dvije litre) - 10 dm 3 Pro 2.
Khimiya
Zagalna kemija
Osnovno razumijevanje, zakoni i teorije kemije
About'êmni vídníní gazív u kemijskim reakcijama. Avogadrov zakon
Gay-Lussacov zakon o
Gazi reagiraju kao i sami na pjevanje generalnih spinova. U 1808. str. J.L. Gay-Lussac je uspostavio sljedeći obrazac: Osyagi plinovi, koji ulaze u reakciju, nose jedan na jedan i produkte reakcije slične plinovima, koji nisu baš veliki brojevi.
Dajemo trag o zakonu vidomije u kemiji jaka zakon o b. Za vas treba voditi računa o plinovima, sudjelovati u reakciji, biti svjestan istih temperatura i poroka.
Svakodnevna komunikacija plinova, koji ulaze u kemijsku reakciju, izvješćuju se o koeficijentima odnosa, na primjer:.
U ovom vypadku 3 volumena vode reagiraju s 1 volumenom dušika, kao rezultat toga se uspostavljaju 2 volumena amonijaka, kako bi se prikazala izvedba.
Zavdannya. Kolika je količina vode potrebna za reakciju s 2 m 3 dušika?
Odluka
Iz reakcije rívnyannya može se vidjeti da je volumen vode 3 puta veći za volumen dušika:
obsyag vodnyu m3.
Avogadrov zakon
Da biste pojasnili jednostavne definicije reaktivnih plinova, upotrijebite Avogadrov zakon: Za iste umove (temperatura i zahvat), isti broj molekula se odvija na istom broju molekula.Zbog Avogadrova zakona nisam popio dva nicoli da:
1) Jedan mol plina za iste umove istog kredita.
Za normalne umove (n. U.), Tobto na temperaturi od 273 K i poroku od 101,3 kPa (1 atm), 1 mol bilo kojeg plina, volumen, rivny 22,4 litre. Tsey obsyag ime molarni plin mislim jak l / mol.
Molarna izmjena može se razviti za formulu
.
2) Uz konstantno držanje, temperatura plina će vjerojatno biti lišena svoje molarne mase.
Tse dopušta izvanredna stipendija prvi plin na drugačiji način:
,
de D- sigurno, kao što vam pokazujem, razvili ste prvi plin koji je važan za druge za iste umove.
Najčešće je propusnost plina normalna. Todi:
; .
Mogu rozrahuvati vídnosnu gustina za be-yaky plin.
Imati širok izbor materijala metodično ogovaranje"Počni rješavati probleme iz kemije". Autor - urednici: nastavnik kemije kategorije hrana, metodičar. metodičar početne metodičke viddilu Uspostaviti edukaciju "Grodno OIC i PRR i SV" Korobova N.P.
Proračun molarnog volumena plinova
Proračun zadanog gustini plina.
About'êmni vídnosini gazív
Jedan mol biti poput plina za iste umove, posuditi? Dakle, za normalne umove (n.o.),tobto. na temperaturama í 0°C í na normalan atmosferski porok, koji košta 101,3 kPa, jedan mol zajma plinu22,4 dm 3.
SvetišteZagrijati ću plin do određene kemijske količine govora ê vrijednost, koja se zovemolarnim plinom (V m):
V m = V/ ndm 3, zvjezdiceV = V m · n
U tu svrhu važno je imati lagan ili važan plin, ali nedovoljno plina;
r 1 / r 2 = M 1 V 1 / M 2 V 2 = M 1 / M 2 = D 2.Može se vidjeti iz vida induciranog viraza: količina proizvodnje plina, količina molarne težine.
Omjer molarne mase jednog plina i molarne mase jednog plina
u dobroj vjeri ( D 2 ) jedan plin iz jednog plina.Poznavajući specifičnost jednog plina u smislu njegove vrijednosti, moguće je odrediti vrijednost njegove molarne mase:
M
1 = M 2 · D 2 .Usput ê puno plina, da s volumenom od 22,4 litara. Vrijednost je brojčano visoka:
M pov. = 29 g/mol
Prema Avogadrovom zakonu, broj molekula različitih plinova je isti za tišinu samih umova koji posuđuju istu količinu.
Od tsyogo vyplya drugi okus.
Pri konstantnim temperaturama stisak plina ulazi u reakciju plinova, jedan prema jedan, a također i na veliki broj plinolikih produkata, koji se uspostavljaju, kao mali broj brojeva.
Zakon lopte je Gay-Lussac formulirao kao zakon običajnog prava. U takvom rangu, ako kemijska reakcija ima puno veze s govorom nalik plinu, tada je za običnu reakciju moguće utvrditi mnogo dokaza.
Osyagi plinovi, scho reagiraju i opsjedaju, proporcionalno kemiji broja riječi:
V 1 / V 2 = n 1 / n 2 tobto. V 1 i V 2
brojčano jednaki koeficijenti pri jednakoj reakciji.dionica 1. Balon vm_shchuê 0,5 kg komprimirane vode. Yakiy ob'êmzajam je toliki? Umovi normalan.
Odluka:
1. Brojna kemija
vodnu, kako se osvetiti u balonu:N
(H2) = 500/2 = 250 (mol), de M (H2) = 2 g/mol.2.Oskilka za normalne umove 1 mol be-like plin zajam obsyag 22,4
dm 3, dakleV = V m · n, V( H 2 ) = 22,4 * 250 = 5600 (dm 3)
Tip: 5600 dm 3
zadnjica 2. Skladište jaka (u%) aluminij-aluminijske legure, kada je uzorkovano 1 g previše klorovodične kiseline i uočeno 1,18 l vodnu?
Odluka:
1.Osks u reakciju s kiselinom ulazi samo aluminij, tadaZapiši:
2A1 + 6HC1 = 2A1C1 3 + 3H 2
2 mol 3 mol
2. Brojni vesela kvaliteta vodnyu:
n(H 2 ) = 1,18 / 22,4 = 0,05 (mol)
3. Prema jednakoj reakciji izračunava se količina aluminija,kako se osvetiti u raftingu:
3 mol 2 mol aluminija
0,05 mol Vidim, reagirat ćuxmol aluminija
x = 0,05 2/3 = 0,033 (mol),
m( Al) = 0,03527 = 0,9 (g), de M (Al) = 27 g/mol
5. Brojni puno aluminija u metalu:
w(Al) = m ( Al ) / m (Legura) , w( A1) = 0,9 / 1 = 0,9 i 90%.
Todi masova dio midi u legure 10%
Tip: 90% aluminij, 10% srednji
dionica 3. Vidljivost valjanosti:b) u vodi s ugljičnim dioksidom.
Odluka:
1. Poznato je da je bogatstvo djece:
D povit (Oko 2) =M(Pro 2) /M (pov.) = 32/29= 1,1.
2.U početku, gustoća u ugljičnom dioksidu po vodnu
D H2 (CO2) =M(Z 2) /M(H 2) = 44/2 = 22.
Pogled: 1.1; 22
dionica 4. Visnite volumen sume plinova, koji se može pohraniti u 0,5 mol kisele, 0,5 mol vodeda 0,5 mol u ugljičnom dioksidu.
Odluka:
1. Poznata je kemija količine plina:
n(zbroj) = 0,5 + 0,5 + 0,5 = 1,5 (mol).
2. Izračunata količina sume plina:
V(zbroj) = 22,4 * 1,5 = 33,6 (dm 3).
Tip: 33,6 dm 3 sum
zadnjica 5. Puknite volumen u ugljičnom dioksidu, kada izgorite 11,2 m 3 metan CH 4.
Odluka:
1. Zapis kemijske reakcije rudarenja metana:
CH4 + 2O2 = CO2 + 2H2O
1 madež1 madež
1 m 3 1 m 3
2. Za izračun količine ugljičnog dioksida u skladištu pohranjuje se u istom omjeru:
kada spava 1 m 3 SN 4 vide 1 m 3 2
kada spava 11,2 m 3 CH 4 Wiide x m 3 2
x = 11,2 1/1 = 11,2 (m 3)
Pogled: 11,2 m 3 u ugljičnom dioksidu
zadnjica 6. Čelični cilindar za cijeđenje stisnutih plinova pohranjen je začinjene kisele mase od 8 kg.
Kakav obsyag zajam od plinskog postrojenja (n.o.)?
Odluka:
1. Brojni kemijski broj autohtone višnje:
n( O 2 ) = 8000/32 = 250 (mol).
2. Brojni obsyag gazopodíbny kisnyu:
V( O 2 ) = 22,4250 = 5600 dm 3.
Tip: 5600 dm 3
zadnjica 7. Izračunajte težinu volumena volumena od 1 m 3 (n.u.), ima 78 voluminoznih dijelova dušika, 21 - kiselog, 1 - argona (osim tih plinova).
Odluka:
1. Bacite pogled na tvornicu, platite benzin na svakom koraku:
V( N 2 ) = 1 · 0,78 = 0,78 m 3;
V(Oko 2) = 1 0,21 = 0,21 m 3
V(Ar) = 1 · 0,01 = 0,01 m 3.
2. Brojne kemijske količine kožnog plina:
n( N 2 ) = 0,78 / 22,4 · 10 -3 = 34,8 (mol),
n(oko 2) = 0,21 / 22,4 · 10 -3 = 9,4 (mol),
n(Ar) = 0,01 / 22,4 · 10 -3 = 0,45 (mol).
3. Brojne plinske mase:
m(N 2 ) = 34,8 28 = 974 (g),
m(Oko 2 ) = 9,4 32 = 30 (g),
m(Ar) = 0,45 40 = 18 (d).
4. Brojno masu povitrya:
m(Povitrya) = 974 + 301 + 18 = 1293 (g) ili 1,293 kg.
Tip: 1,293 kg na sat
zadnjica 8. Kada se doda u mjerač, količina vode je 0,1 m 3 volumen zbroja promijenjen za 0,09 m 3 .
Yaki obsyagivoda i kiseli nasilnik na opake svote, kako gori plin koji se prelijeva (n.o.)?
Odluka:
1. Zapišite reakciju:
2H 2 + Oko 2 = 2H 2 Oko
2 mol 1 mol 2 mol
2. Visnachaêmo obsyagi plin, scho je ušao u reakciju.
obsyag plinski metež ubrzao je za odobrenje divljih voda, pa je puno plina, koji je ušao u reakciju, koštao 0,09 m 3 .
Jer gazi unesite reakciju 2:1, zatim s 0,09 m 3 dva dijela
padne na vodu, a jedan - na poljupcu. Otzhe, na reakciju
ušao 0,06 m 3 dubina vode 0,03 m 3 kiseo sam.
3. Brojni obsyagi plinova u zlim iznosima.
Jer plin, koji je zasjenjen, spali, tada je cijena dana 0,01 m 3 .
V(H 2 ) = 0,01 + 0,06 = 0,07 (m 3 ) oko 70 l,
V(Oko 2 ) = 0,1 - 0,07 = 0,03 (m 3 ) ili oko 30 litara.
Tip: 70 litara vode, 30 litara vode
zadnjica 9. Zašto biste željeli pohraniti do 56 litara argona i 28 litara dušika (n.o.)?
Odluka:
1. Vyhodyachny viznennya vídnosí gustini gazív,
D H 2 = M (sumíshí) / M(H 2 ).
2. Brojne kemijske količine iste količine plina:
n(Ar) = 5,6 / 22,4 = 2,5 (mol);
n(N 2 ) = 28/22,4 = 1,25 (mol);
n(zbroj) = 2,5 + 1,25 = 3,75 (mol).
m(Ar) = 2,5 40 = 100 (g),
m(N 2 ) = 1,25 28 = 35 (g),
m(sumíshí) = 100 + 35 = 135 (g), jer
M (Ar) = 40 g/mol, M (N 2 ) = 28 g/mol.
3. Izračunata molarna masa zbroja:
M (sumíshí) = m (sumíshí) / n (sumíshí) ;
M (sumíshí) = 135 / 3,75 = 36 (g / mol)
4. Brojčana vrijednost količine plina u vodi je:
D H 2 = 36/2 = 18.
Pogled: 18
dionica 10. Koliko mogu spaliti 3 g drva od trilitrovog banci, koji podsjeća na kiselo (n.u.)?
Odluka:
1. Zapis o reakciji mine vugilya:
Z + Oko 2 = CO 2
1 mol 1 mol
2. Brojni kemijski broj vugilya:
n(S) = 3/12 = 0,25 (mol), dakle M (C) = 12 g/mol.
Dobra količina kiselog, potrebnog za reakciju, ako je i potrebno 0,25 mol (na temelju tipične reakcije).
3. Za spavanje 3 g vugila potreban je brojni volumen:
V(O 2 ) = 0,25 22.4 = 5,6 (l).
4. Oskilki plin posuđuje se po količini presude, u kojoj se nalazi, ê 3 litre kiselog. Otzhe, tsíêí̈ kílkostí ne zviždi za spavanje 3 g vugila.
Gledajte: nemojte miješati
dionica 11. Želite li razviti puno plodne vode i nekoliko puta kada je to normalno?
Za kemijsku reakciju aA + bB = cC + dD
pojaviti se
de nA i nV - broj neredovnog govora koji je ušao u reakciju, pS i nD - broj proizvoda koji su odobreni, a, b, c í d - stehiometrijska izvedba.
Od broja riječi lako je prijeći na njihovu masu:
Za govore poput plina često je potrebno postaviti broj puta. Ako su reagens i proizvod D plinovi, tada se vrši prijelaz od broja riječi do broja izmjena:
![]()
Za vídomih (za um) nekolicine, i za puno novca (za plin) jedan od govora, tako da možemo sudjelovati u reakciji, moguće je razviti značenje svih vrijednosti za drugi govori.
Ako imate puno plinova A i B, jedan od njih će zauzeti sudbinu reakcije, možete znati uzeti odnos ovih izvješća VA: VB, i po danoj stopi - onih stranaka (ili navpaki).
Rješavanje problema s guzom
Pri visokim temperaturama magnezij reagira s dušikom, uzetom iz zbroja s argonom, u volumenu od 5,6 l (n.u.) i 15 g nitrida. Zaštitite podatke o V (N2): V (Ar) u trenutnom stanju stvari.


Zavdannya za neovisno rješenje dio A
1. Reagiralo je 6 litara dušikovog oksida (II) iz 5 litara kiseline (okoštavanje za vimiryana za ryvnyh umova), također, u posljednjem zbroju, oko jedan
2. Spalili su 24 g grafita u 67,2 litre (n.u.) u zatvorenoj posudi, a skinuli su ga oko mene.
3. Propušteno kroz ozonator 7,5 mol kiselo, koje se djelomično obnavlja s ozonom. Preostali rast vitrakcije za "spalyuvannya" (za normalne umove) 0,5 mola vode (koja se pretvara u SO2); U isto vrijeme, količina O3:O2 ulaza na izlazima iz ozonatora je postala
4. Kalcijev bromid mase 142,8 g reagirao je samo u području klora, uzetog iz velike količine hrane u količini 1 (klor): 2 (možda). Zagalny obsyag (na slovima) vikhídnoí̈ sumíshí gazív buv
5. Za dodatno izgaranje od 17,92 l (n.u.) sume CH4 + H2 potreban je 1 mol kiseline. Prema trenutnim iznosima o meni, isporuka CH4:H2:
6. Plin A je prženjem 0,04 mola KClO3 na katalizatoru izgubio (na n. , pivnim
7. Dovođenje nitrobenzena u višak kiselosti uzima se iz količine proizvoda (dušik, plin ugljični dioksid, voda), u kojoj se zamjenjuje 4 litre (na) dušika, a količina N2:O2 se dovodi u 4:1 litru. .... y.) kiselo, postajanje
8. Provedena toplinska distribucija 1 mol amonijevog klorida u čeličnom balonu, kao i 11,2 litre (standardnog) amonija. Kintsev o'êmne vídnoshennya NH3: NCl dorívnyu
9. Sumy kiselo i klor s volumetrijskim učinkom 9: 1 vikoristan za gledanje 0,5 mol praznog govora za raspon KI, iz istog izvora informacija (u litrama, n. U.)
10. Kisin je propušten kroz ozonator, kada je 1 mol KClO3 pržen na katalizatoru, na 5% kiselina je pretvorena u ozon, a na izlazima iz ozonatora količina O2:O3 je uklonjena
Fizikalno-kemijski zakoni nastajanja tankotopljenih metal-polimernih sustava iz plinske faze
Tanko otopljeni metal-polimerni materijali (metalizirani polimeri, metal-virobi s tankim polimernim premazima, bagato-ball sustavi, itd.), koji se oblikuju vakuumskom tehnologijom.
Epitaksijalni rast Ge na površini Si (100)
S fizikom delikatnih pramenova vezanih i izgledima za daljnji razvoj mikroelektronike, optike, adaptacija i ostalih galuzija nove tehnologije. Uspjesi mikrominiaturizatsii elektron ...
Komponente koje mogu smanjiti snagu za smanjenje zapaljivosti polimernih materijala
Shoroku može pokrenuti ekonomiju zemlje poslovnih ljudi od stotina milijuna rubalja. Kod spaljivanja polidimenzionalnih materijala, vidi veliki broj otrovni plinovi, štetan za ljude i...
Svrha lekcije:
Revizija dokumenta
“Kemija 9. razred. Nabrajanje uobičajenih spívvídnoshenní gazív za chemíchníy ívnyannyi.
Sat iz kemije na temu „O uobičajenim plinovima u kemijskim reakcijama. Nabrajanje uobičajenih spívvídnoshenní gazív za chemíchníy ívnyannyi "
Lekcija br. 3 za tehniku kritičnog nedostatka
Svrha lekcije: formuliranje znanja o zakonu zajedničkih denominacija za plinoliki govor sa sučeljem kemijskih reakcija organskog govora; oblikovati vminnya zastosovuvati zakon o amnestiji spívvídnoshen za rozrahunív íf chemích pívnyany. Bez sumnje, na popisu znanstvenika, virishuvati rozrakhunkovs su razvijeni i pripremljeni za razvoj kemijskih reakcija. Razvoj znanstvenika, skladištenje kemijskih postrojenja. Razvoj je važniji od misije. Formuvati se pozitivno stavlja ispred subjekta, sumarno se stavlja ispred subjekta.
Posjed: kartica-zavdannya.
Idi na lekciju.
ja.Zagrijati se(Učim se izgubiti prije nego što uhvatim svoje misli)
A. Frans "Ako krivo protumačiš ljud, neće se pobijediti, ale pobijedio, ako ..."
Yak bi vee završio frazu qiu?
Praksa učenja u grupama. Zapišite predložene opcije. Vibrirajte to, dok više idete u svoje misli.
Visnovok: "Ako si propustio ljudin, neću ga dobiti, neće mi biti čast, ako nisam."
Potaknut sam, s desne strane, dok sam angažiran na tečaju, da vas povežem i vidim vaše zdravlje i pamćenje.
II. Motivacija za obrazovni učinak.
Zapanjen onima koji zavdan lekciju.
Sh. Korak aktualizacije
Za dijagram Dan Odluke Kemije vlasti Alkenija i Alkeniva.
Što se događa molarna izmjena be-kao plin za n.u.
Pogled: 22,4 l/mol
Kako je formuliran Avogadrov zakon?
Pogled: Isti broj molekula za iste umove (t, p) ima isti broj molekula.
Visnovok: Količina plinovitih reagensa i produkti reakcije koriste se za smanjenje učinkovitosti reakcije. Pravilo je biti pobjednik za projekte iz kemije.
Kreativni zavdannya:(Da, možete se obratiti na pouzdano znanje znanstvenika o toj temi)
U tri numerirane epruvete, zatvorene čepovima, ê: metan, etilen, acetilen. Kakva vrsta plina postoji?
IV... Faza učenja(Dovođenje do znanja znanstvenog materijala, kako se spiralno baviti problemom, šala istine).
Predavanje je ojačano ("Vrtuljak": osnovno je razumijevanje škole;
O kloru (n.u.), koji ulazi u reakciju sa 7 litara propena, dorívnyuê:
a) 14 l; b) 10 l; c) 7 l; d) 22,4 litre.
3. Izračunajte količinu novca koja vam je potrebna za novac za spavanje,
spremiti za 5 litara etilena i 7 litara acetilena (n.o.).
Treba napomenuti da je za rehidraciju 7 litara etilena potreban volumen vode, ovisno o reakciji:
Z 2 H 4 + H 2 = Z 2 H 6 a) 7 l; b) 6 l; c) 14 l; d) 3,5 l.
Robot je u paru. Znanstvenici će, nakon što su se okladili, pohraniti još nekoliko zaposlenika, kao posljednji par:
Volumen vode potreban za ponovnu hidrataciju od 15 litara butynu, za isporuku: a) 15 litara; b) 30 l; c) 7,5 l; d) 3,5 l.
Određeni volumen klora koristi se do 5 litara acetilena kao preduvjet za reakciju S 2 N 2 + 2Cl 2 = S 2 N 2 Cl 2
a) 5 l; b) 10 l; c) 2,5 l; d) 22,4 litre.
3. Prebrojite količinu novca, jer je potrebno vitrirati za spas
10 m3 acetilena (n.o.).
V... Refleksija
Posjet kartice.
Izračunajte iznos novca potreban za opću podršku govoru H.
(Znanstveno samostalno zapovnyayut tablicu, kada robot bude gotov, bit će prikazan).
| Obsyag govor X, l | Formula govora X | Rivnyannya gidruvannya | vodnyu, l |
|
VІ ... Visnovki u lekciji
Formuliranje uvredljive lekcije.
VІ ja... Torbe za lekciju
VIII... Početna zavdannya
Nastavite na paragraf 23, viconati desno 206, 207 sa strane.