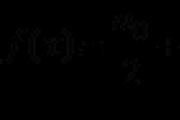Demo kimianya. Trivalitas DI z kimia
Pada 14 November 2016, versi yang disetujui diterbitkan di situs web FIPD pilihan demonstrasi, kodifier dan spesifisitas bahan kontrol penelitian keadaan tunggal dan penelitian keadaan utama tahun 2017, termasuk kimia.
Versi demo dari DI z khimiї 2017
| Opsi zavdan + vіdpovіdі | Dapatkan versi demo |
| Spesifikasi | varian demo himiya ege |
| pengkode | pengkode |
Versi demo EDI z chemistry 2016-2015
| Kimia | Dapatkan versi demo + ulasan |
| 2016 | tahun 2016 |
| 2015 | tahun 2015 |
Di KIM z khimiї u 2017 roci suttєvі chіnі, jadi versi demo dari nasib masa lalu telah dibawa untuk klarifikasi.
Kimia - inti dari perubahan: Struktur pekerjaan ujian dioptimalkan:
1. Struktur KIM bagian 1 berubah secara mendasar: tugas dimatikan dengan pilihan satu calon; tugas pengelompokan untuk blok tematik okremi, untuk kulit s seperti tugas yang dasar, dan lipat tingkat lanjutan.
2. Mengubah jumlah pekerjaan dari 40 (2016) menjadi 34.
3. Skala penilaian (dari 1 hingga 2 poin) diubah menjadi kepala pelipatan tingkat dasar, untuk mempertimbangkan kembali pengetahuan yang diperoleh tentang hubungan genetik pidato anorganik dan organik (ke-9 dan 17).
4. Skor pertama maksimum untuk robotika pemenang adalah 60 poin (menggantikan 64 poin untuk 2016).
Trivalitas DI z kimia
Total durasi periode ujian adalah 3,5 tahun (210 menit).
Perkiraan jam, saat vikonanny okremikh zavdan dimulai, menjadi:
1) untuk pengaturan kulit tingkat dasar pelipatan bagian 1-2-3 duri;
2) untuk perawatan kulit dipromosikan setara bagian lipat 1-5-7 duri;
3) untuk perawatan kulit lipat tingkat tinggi, bagian dari 2-10-15 duri.
Spesifikasi
bahan kontrol
untuk rotasi Spitu Amerika Serikat tahun 2017
KIMIA
1. Pengangkatan KIM EDI
Satu-satunya pengalaman negara (selanjutnya - ) adalah bentuk penilaian objektif terhadap kualitas pelatihan siswa, karena mereka telah menguasai program pendidikan menengah. pendidikan global, Dari pemilihan bentuk standar (bahan kontrol).
dilakukan sesuai dengan Undang-Undang Federal 29 Desember 2012 No. 273-ФЗ "Tentang Pendidikan di Federasi Rusia".
Bahan kontrol memungkinkan untuk menetapkan tingkat penguasaan oleh lulusan komponen Federal dari standar negara bagian dari pendidikan global menengah (baru) dalam tingkat kimia, dasar dan profil.
Hasil penelitian berdaulat tunggal dalam kimia diakui oleh organisasi pencahayaan menengah pendidikan profesional dan mencerahkan organisasi pendidikan profesional yang lebih tinggi sebagai hasil dari ujian masuk di bidang kimia.
2. Dokumen yang akan dikeluarkan oleh KIM EDI
3. Datang ke pemilihan pengganti, analisis struktur KIM EDI
Dasar masukan sebelum pendistribusian KIM EDI 2017 z khіmії dilipat zagalnі instalasi metodis, yakі ditunjuk dalam proses pencetakan model ujian batuan sebelumnya. Inti dari instalasi ini adalah sumbu y.
- berorientasi pada verifikasi ulang sistem pengetahuan yang diperoleh, yang dianggap sebagai inti invarian dari program pengembangan yang sama dalam kimia untuk organisasi pencahayaan global. Pada standar, sistem pengetahuan disajikan sebagai bantuan untuk persiapan lulusan. Zimi vymogami spіvvіdnositsya rіvennja prіvlennya dalam elemen KІM vmіstu, scho verіryayutsya.
- Untuk memastikan kemungkinan membedakan penilaian pencapaian awal lulusan KIM DI zdіysnyyuyut, verifikasi ulang penguasaan program pendidikan utama dalam kimia pada tiga tingkat kompleksitas: dasar, lanjutan dan tinggi. bahan awal, fondasi yang akan menjadi tugas, dipilih sebagai tanda signifikansinya bagi pendidikan global lulusan di sekolah menengah.
- Vikonannya zavdan ekzamenatsiynoi roboti mentransfer zdiisnennya bernyanyi sukupnosti diy. Di antara mereka, yang paling mencolok adalah, misalnya, seperti ini: menunjukkan tanda-tanda pengklasifikasi ucapan dan reaksi; pilih keadaan oksidasi unsur kimia di balik rumus titik koma mereka; menjelaskan esensi dari proses chi nshoy, gudang vzaєmozv'yazku, menjadi kekuatan pidato. Vmіnnya izmenovanogo zdіysnyuvati raznomanіtnі dії di vykonannye roboti dilihat sebagai indikator asimilasi materi bengkok dengan kedalaman pemahaman yang diperlukan.
- Kesetaraan semua varian pekerjaan ujian dipastikan dengan pengenalan tingkat kualifikasi tugas yang sama, yang dipertimbangkan kembali dengan perolehan elemen utama dari divisi utama kursus kimia.
4. Struktur KIM EDI
Varian kulit dari pekerjaan pemeriksaan bisikan untuk satu rencana: pekerjaan terdiri dari dua bagian, yang mencakup 40 tugas. Bagian 1 dari hari ke-35 dari istirahat pendek, di tengah-tengahnya hari ke-26 dari tingkat dasar lipat (nomor urut pesanan: 1, 2, 3, 4, ... 26) dan hari ke-9 tingkat lipat lanjutan (urutan hari pemesanan: 27, 28, 29 , …35).
Bagian 2 untuk membalas hari ke-5 dari pelipatan tingkat tinggi, dengan api terbuka (nomor urut dari perintah ini: 36, 37, 38, 39, 40).
Tes khas tugas kimia dilakukan 10 varian set tes, dilipat untuk peningkatan fitur yang diperlukan dan demi tidur berdaulat tunggal pada tahun 2017. Tujuan dari bantuan tersebut adalah untuk memberikan informasi kepada pembaca tentang struktur KIM 2017 kajian kimia, tingkat kerumitan tugas.
Sampler diberi pendapat tentang semua opsi tes dan keputusan dibuat pada semua tugas dari salah satu opsi. Selain itu, tanda-tanda blanko digambar, seolah-olah mereka menang di DI, untuk mencatat pendapat dari keputusan itu.
Penulis adalah ilmuwan terkemuka, juru tulis dan ahli metodologi, yang mengambil bagian tanpa gangguan dalam pengembangan bahan vimiruvalnyh kontrol EDI.
Pembantu janji temu untuk guru untuk persiapan siswa untuk belajar kimia, serta untuk siswa sekolah menengah dan mahasiswa pascasarjana - untuk pelatihan diri dan pengendalian diri.
berlaku.
Amonium klorida memiliki ikatan kimia:
1) ionnі
2) kutub kovalen
3) kovalen non-polar
4) air
5) logam
Dari terjemahan pidato yang propionated, bungkus dua pidato, dengan kulit bereaksi dengan beberapa reaksi.
1) seng klorida (larutan)
2) natrium sulfat (larutan)
3) asam nitrat encer
4) asam sulfat pekat
5) aluminium oksida
ZMIST
Peredmova
Instruksi untuk robot vikonannya
PILIHAN 1
Bagian 1
bagian 2
PILIHAN 2
Bagian 1
bagian 2
OPSI 3
Bagian 1
bagian 2
OPSI 4
Bagian 1
bagian 2
OPSI 5
Bagian 1
bagian 2
OPSI 6
Bagian 1
bagian 2
OPSI 7
Bagian 1
bagian 2
OPSI 8
Bagian 1
bagian 2
OPSI 9
Bagian 1
bagian 2
OPSI 10
Bagian 1
bagian 2
LIHAT PERBEDAANNYA
Vіdpovіdі sampai kepala bagian 1
Keputusan dan batas waktu untuk bagian 2
Varian tugas Razv'yazanya 10
Bagian 1
Bagian 2.
zavantazhiti . bebas biaya buku elektronik dalam format manual, kagumi dan baca:
Unduh buku 2017, Kimia, Tugas tes khas, Medvedev Yu.M. - fileskachat.com, unduhan gratis.
- DI 2020, Kimia, Pilihan umum untuk pertanyaan ujian di DI pengecer, Medvedev Yu.M., 2020
- DI 2019, Kimia, Ahli di DI, Medvedev Yu.M., Antoshin A.E., Ryabov M.A.
- ODE 2019, Kimia. 32 opsi, Tes jenis untuk distribusi ODE, Molchanova G.M., Medvedev Yu.M., Koroshenko O.S., 2019
- Kimia, satu-satunya tes berdaulat, Bersiap untuk pengesahan sub-kantong, Kaverina A.A., Medvedev Yu.M., Molchanova G.M., Sviridenkova N.V., Snastina M.G., Stakhanova S.V., 2019
Untuk vikonannya zavdan 1-3 vikoristovyte baris berikutnya dari elemen kimia. Vіdpovіddu di zavdannya 1-3 urutan angka, di mana unsur-unsur kimia ditunjukkan dalam baris ini.
1) Na 2) K 3) Si 4) Mg 5) C
Manajer No. 1
Secara signifikan, atom dari beberapa arti dari sejumlah elemen mungkin berada di luar energi sama elektronik chotiri.
Saran: 3; lima
Jumlah elektronik pada tingkat energi yang sama (bola elektronik) dari elemen-elemen dari subkelompok utama sama dengan jumlah grup.
Dalam peringkat seperti itu, silikon dan batu bara cocok untuk mengirimkan opsi untuk vіdpovіdey, karena stinks membeli kembali dari subkelompok kepala kelompok keempat tabel D.I. Mendeliev (grup VA), tobto. virnі vіdpovіdі 3 dan 5.
Manajer No. 2
Dari penunjukan sejumlah unsur kimia, pilih tiga unsur, seperti pada sistem periodik unsur kimia D.I. Mendeliev membeli kembali dalam satu periode. Simpan elemen yang dipilih dalam urutan pertumbuhan kekuatan logamnya.
Tulis di bidang jumlah elemen yang dipilih dalam urutan yang diperlukan.
Saran: 3; 4; satu
Ada tiga representasi unsur dalam satu periode - natrium Na, silikon Si dan magnesium Mg.
Di Rusia di perbatasan periode Tabel Periodik D.I. Mendeliev (baris horizontal) tangan kanan ke kiri, lebih mudah untuk memberikan elektronik, menyebarkannya ke bola luar, tobto. kekuatan logam dari unsur-unsur diperkuat. Dengan cara ini, dominasi logam natrium, silikon dan magnesium diperkuat dalam seri Si Manajer No.3 3-nilai alternatif dalam sejumlah elemen, pilih dua elemen, karena mereka mengungkapkan keadaan oksidasi yang lebih rendah, sama dengan -4. Tuliskan jumlah elemen yang dipilih di lapangan. Saran: 3; lima Sebagai aturan, sebuah oktet, atom unsur kimia, harus memiliki elektron elektron level 8 yang sama, seperti dalam gas mulia. Apa yang dapat dicapai baik dengan memberikan elektron yang tersisa, sama dengan elektron depan, yang dapat membalas 8 elektron, atau dengan menambahkan elektron tambahan hingga delapan. Natrium dan kalium naik menjadi logam genangan dan ditemukan di subkelompok kepala kelompok pertama (IA). Tse berarti bahwa bola elektron yang sama masing-masing memiliki satu elektron. Pada link dengan cym penuh semangat vygіdnіshoy vtrata elektron tunggal, lebih rendah dari penambahan tujuh lebih. Dengan magnesium, situasinya serupa, hanya anggur yang berada di subkelompok kepala kelompok lain, sehingga ada dua elektron pada tingkat elektronik utama. Perlu dicatat bahwa natrium, kalium dan magnesium ditempatkan sebelum logam, dan logam pada prinsipnya tidak dapat memiliki tahap oksidasi negatif. Tingkat oksidasi minimum logam apa pun sama dengan nol dan diamati dalam pidato sederhana. Unsur-unsur kimia batubara C dan silikon Si non-logam dan berada di kepala subkelompok kelompok keempat (IVA). Tse berarti ada 4 elektron pada bola elektron terluarnya. Oleh karena itu, untuk elemen-elemen ini, dimungkinkan untuk memasok elektronik ini, sehingga dimungkinkan untuk menambahkan lebih banyak ke angka besar, yang lebih mahal 8mi. Lebih dari 4 elektron untuk atom silikon dan karbon tidak mungkin, sehingga tingkat oksidasi minimum adalah -4. Manajer No.4 Pilih dua semester dari campuran proponated, di mana ada link kimia ionik. Saran: 1; 3 Kehadiran ikatan tipe ionik dalam senyawa dengan cara yang paling penting dapat dikaitkan dengan fakta bahwa atom logam khas dan atom non-logam masuk ke salah satu unit struktural pada saat yang sama. Untuk tujuan tersebut, kita akan menetapkan bahwa ikatan ion adalah sama di bawah nomor 1 - Ca (ClO 2) 2, tk. dalam formula ini, dimungkinkan untuk memasok atom kalsium logam khas dan atom non-logam - asam dan klorin. Namun, tidak ada lagi kesempatan untuk membalas dendam pada atom-atom logam dan non-logam dalam daftar yang ditunjuk. Ada lebih banyak tanda, tentang adanya ikatan ionik dalam kehidupan sehari-hari, dapat dikatakan bahwa di gudang satu unit struktural terdapat kation amonium (NH 4 +) atau analog organik lainnya - kation alkilamonium RNH 3 +, dialkilamonium R 2 NH 3 N + i tetraalkylammonium R 4 N + , de R - radikal karbohidrat deaky. Misalnya, jenis ikatan ionik dapat ditemukan pada sambungan (CH 3) 4 NCl antara kation (CH 3) 4 + dan ion klorida Cl - . Bagian tengah dari janji di pabrik adalah amonium klorida, di sisi lain ikatan ion diwujudkan antara kation amonium NH 4 + dan ion klorida Cl . Manajer No.5 Atur posisi antara rumus pidato dan kelas / kelompok, untuk berbaring ke jenis (-oї) pidato: ke posisi kulit, ditunjukkan dengan huruf, pilih posisi dari posisi lain, ditunjukkan dengan angka. Tuliskan nomor hari yang dipilih di lapangan. Kesaksian: A-4; B-1; 3 Penjelasan: Garam asam disebut garam, yang muncul sebagai hasil substitusi tidak lengkap atom rukhomi dalam air untuk kation logam, kation amonium, atau alkilamonium. Dalam asam anorganik, yang melewati kerangka program sekolah, semua atom dan air busuk, sehingga dapat digantikan oleh logam. Butt garam asam anorganik dari media yang disajikan dalam daftar adalah amonium bikarbonat NH 4 HCO 3 - produk substitusi salah satu dari dua atom air dalam asam karbonat untuk kation amonium. Faktanya, kekuatan asam berada di antara keasaman normal (rata-rata). Dalam kasus NH 4 HCO 3 - medium antara ambang normal (NH 4) 2 CO 3 dan asam karbonat H 2 CO 3. Dalam pidato organik, hanya atom dan air yang diganti pada atom logam, yang memasuki gudang gugus karboksil (-OOH) atau gugus hidroksil fenol (Ar-OH). Tobto, misalnya, natrium asetat CH 3 COONa, terlepas dari mereka yang dalam molekul ini tidak semua atom dan substitusi air pada kation logam, medium, dan asam tidak asam (!). Air atom dalam pidato organik, dilampirkan tanpa bagian tengah ke atom karbon, praktis tidak mungkin untuk menggantinya dengan logam atom, untuk air atom dalam air dengan tautan tiga C-W. Oksida pembentuk garam - oksida non-logam, yak utvoryut dengan oksida basa dan basa garam, sehingga mereka tidak bereaksi dengannya (paling sering), atau reaksi dengannya memiliki produk lain (tidak kuat ). Sering terlihat bahwa oksida non-garam adalah oksida non-logam yang tidak bereaksi dengan basa dan oksida basa. Prote, manifestasi oksida non-garam adalah spratsovuє zavzhd seperti itu. Jadi, misalnya, CO, sebagai oksida non-garam, bereaksi dengan oksida utama garam (II), tetapi dengan larutan bukan garam, tetapi logam bebas: CO + FeO = CO2 + Fe Untuk oksida non-garam dalam pelajaran kimia sekolah menengah, oksida non-logam termasuk dalam tahap oksidasi +1 dan +2. Usy adalah sustrichaetsya di DI 4 - tse CO, NO, N 2 O dan SiO (sisa SiO tidak terlalu sustrichavsya di zavdannya). Manajer No.6 Dari terjemahan pidato propionated, bungkus dua pidato, dari kulit, yang bereaksi dengan baik tanpa pemanasan. Saran: 2; 4 Seng klorida ditambahkan ke garam, dan seng klorida - ke logam. Logam bereaksi dari konyol hanya dalam kasus itu, karena lebih aktif pada saat yang sama, yang memasuki gudang garam. Aktivitas logam yang signifikan disebabkan oleh aktivitas logam yang rendah (dengan kata lain, serangkaian tekanan logam). Zalizo dalam rangkaian aktivitas logam lebih tepat untuk seng, tetapi kurang aktif dan tidak lebih mungkin untuk menghilangkan seng dari garam. Itu sebabnya reaksi aula dari pidato No. 1 tidak berjalan. Sulfat midi (II) CuSO 4 akan bereaksi dengan garam, karena air liur terdaftar sebagai midi dalam rangkaian aktivitas, sehingga merupakan logam yang lebih aktif. Asam nitrat pekat, serta asam sulfat pekat, tidak bekerja tanpa pemanasan, bereaksi dengan panas, aluminium, dan kromium dalam munculnya fenomena seperti itu, sebagai pasivasi: pada permukaan logam ini, tidak mungkin untuk berubah pentingnya asam, tanpa memanaskan gaya, seolah-olah di Prote ketika dipanaskan, sekam mengembang dan reaksi menjadi mungkin. tobto. pecahan ditugaskan, saya tidak bisa memanaskan, reaksi aula dengan conc. HNO 3 tidak bocor. Asam klorida dapat ditambahkan ke asam non-pengoksidasi terlepas dari konsentrasinya. Mereka bereaksi dengan asam non-pengoksidasi dengan air, yang seharusnya berada di sebelah aktivitas air. Untuk logam seperti itu terletak dekat. Visnovok: reaksi banjir dengan kebocoran asam klorida. Pada saat logam dan oksida logam, reaksi, seperti dan dalam depresi dari konyol, adalah mungkin, karena logam yang lebih aktif adalah untuk mereka yang memasuki gudang oksida. Fe, dekat dengan aktivitas logam, kurang aktif, Al lebih rendah. Tse berarti Fe s Al 2 O 3 tidak bereaksi. Manajer No.7 Dua oksida diambil dari perelika proponated, karena mereka bereaksi dengan asam klorida yang berbeda, ale jangan bereaksi
dari berbagai natrium hidroksida. Tuliskan nomor pidato yang dipilih di lapangan. Saran: 3; 4 CO adalah oksida non-salin, tidak bereaksi dengan padang rumput air. (Mengikuti memori, sho, tidak kurang, dalam pikiran zhorst - tekanan dan suhu tinggi - anggur masih bereaksi dengan padang rumput yang keras, membentuk bentuk - garam asam format.) SO 3 - oksida belerang (VI) - oksida asam, yang mirip dengan asam sulfat. Oksida asam tidak bereaksi dengan asam dan oksida asam lainnya. Jadi SO 3 tidak bereaksi dengan asam klorida dan bereaksi dengan basa - natrium hidroksida. Jangan pergi. CuO - midi (II) oksida - dapat dibawa ke oksida dengan kekuatan utama. Bereaksi dengan HCl dan tidak bereaksi dengan natrium hidroksida. Datang MgO - magnesium oksida - dapat dibawa ke oksida dasar yang khas. Bereaksi dengan HCl dan tidak bereaksi dengan natrium hidroksida. Datang ZnO - oksida dengan kekuatan amfoter yang jelas - mudah bereaksi dengan basa kuat dan asam (serta oksida asam dan basa). Jangan pergi. Manajer No.8 Saran: 4; 2 Dalam reaksi antara dua garam asam anorganik, gas cenderung tidak larut ketika nitrit panas dan garam amonium bercampur setelah amonium nitrit yang tidak stabil secara termal dilarutkan. Sebagai contoh, NH 4 Cl + KNO 2 \u003d t o \u003d\u003e N 2 + 2H 2 O + KCl Namun, daftar tersebut tidak termasuk nitrit, dan garam amonium. Juga, salah satu dari tiga garam (Cu(NO 3) 2 , K 2 SO 3 dan Na 2 SiO 3) bereaksi baik dengan asam (HCl) atau dengan padang rumput (NaOH). Di antara garam asam anorganik, hanya garam amonium yang melihat gas saat berinteraksi dengan padang rumput: NH 4 + + OH \u003d NH 3 + H 2 O Garam amonium, seperti yang telah kami katakan, tidak ada daftarnya. Tidak ada lagi pilihan untuk interaksi garam dengan asam. Pada garam-garam daerah tengah dibubuhkan Cu (NO 3) 2, K 2 SO 3 dan Na 2 SiO 3. Reaksi midi nitrat dari asam klorida tidak berlangsung, karena jangan puas dengan gas, atau pengepungan, atau pidato disosiasi rendah (timbal atau asam lemah). Natrium silikat bereaksi dengan asam klorida; Na 2 SiO 3 + 2HCl \u003d 2NaCl + H 2 SiO 3 Pilihan yang tersisa ditinggalkan - interaksi kalium sulfit dan asam klorida. Memang, sebagai hasil dari reaksi pertukaran ion antara sulfit dan hampir semua asam, asam non-sulfur dilarutkan, pada kenyataannya, ia terurai menjadi oksida sulfur (IV) dan air seperti gas tanpa batang. Manajer No.9 Tulis dalam tabel jumlah pidato yang dipilih di bawah huruf yang sesuai. Saran: 2; lima CO 2 dibawa ke oksida asam dan, untuk mengubahnya menjadi kekuatan, perlu untuk menaikkannya dengan oksida basa atau basa. tobto. Untuk menghilangkan kalium karbonat dari CO2, perlu menambahkan kalium oksida atau kalium hidroksida ke dalamnya. Dalam urutan ini, ucapan X adalah kalium oksida: K 2 O + CO 2 \u003d K 2 CO 3 Kalium bikarbonat KHCO 3, yak dan kalium karbonat, sіllyu vugіlnoї asam, tієyu lebih sedikit perbedaan, scho bikarbonat produk substitusi tidak lengkap atom dalam air dari asam vugіlnіy. Untuk menghilangkan garam normal (tengah), kekuatan asam, perlu atau naik di atasnya dengan asam berat, yang merupakan kekuatan yang ditetapkan, atau untuk menaikkannya dengan oksida asam, yang memperburuk asam ini, dengan adanya air. Jadi, reagen Y adalah karbon dioksida. Ketika yoga dilewatkan melalui larutan air, kalium karbonat tetap berpindah ke kalium bikarbonat: K 2 CO 3 + H 2 O + CO 2 \u003d 2KHCO 3 Manajer No. 10 Atur perbedaan antara reaksi dan kekuatan elemen menjadi nitrogen, seolah-olah dalam reaksi Anda: ke posisi kulit, ditunjukkan dengan huruf, untuk mengambil posisi yang benar, ditunjukkan dengan angka. Tulis dalam tabel jumlah pidato yang dipilih di bawah huruf yang sesuai. Kesaksian: A-4; B-2; DALAM 2; G-1 A) NH 4 HCO 3 - kekuatan, ke gudang, yang mencakup kation amonium NH 4 +. Pada kation amonium, nitrogen merupakan tahap oksidasi utama, yaitu -3. Sebagai hasil dari reaksi, anggur diubah menjadi amonia NH 3 . Air praktis zavzhdi (krim yogo spoluk z logam) maє tahap oksidasi, yang baik +1. Untuk fakta bahwa molekul amonia secara elektrik netral, nitrogen harus disalahkan untuk ibu dari tahap oksidasi, yang sehat -3. Otzhe, mengubah tahap oksidasi menjadi nitrogen tidak mungkin, tobto. anggur tidak menunjukkan kekuatan dominan oksida. B) Seperti ditunjukkan di atas, nitrogen dalam amonia NH 3 dapat dioksidasi menjadi -3. Sebagai hasil dari reaksi dengan CuO, amonia diubah menjadi ucapan sederhana N 2 . Di hadapan pidato sederhana, tahapan oksidasi elemen, seolah-olah ditetapkan, sama dengan nol. Dengan cara ini, atom nitrogen kehilangan muatan negatifnya, dan pecahan muatan negatif memberikan elektron, yang berarti bahwa atom nitrogen kehilangannya sebagai akibat dari reaksi. Unsur yang kehilangan sebagian elektronnya akibat reaksi disebut sumber. C) Sebagai hasil dari reaksi NH 3 dengan tahap oksidasi menjadi nitrogen, yang mengarah ke -3, diubah menjadi nitrogen oksida NO. Kisen praktis menanam tingkat oksidasi tertinggi, yaitu -2 yang baik. Agar molekul nitrogen oksida menjadi netral secara elektrik, atom nitrogen bertanggung jawab atas ibu dari keadaan oksidasi +2. Tse berarti atom nitrogen setelah reaksi mengubah langkah oksidasinya dari -3 menjadi +2. Tidak ada gunanya berbicara tentang hilangnya 5 elektron oleh atom nitrogen. Tobto nitrogen, seperti dan trapleyaetsya B, vіdnovnikom. D) N 2 - pidato sederhana. Dalam semua pidato sederhana, elemen yang membuatnya, mungkin memiliki tingkat oksidasi yang sehat 0. Sebagai hasil dari reaksi, nitrogen diubah menjadi lithium nitrida Li3N. Satu tahap oksidasi logam genangan, krim nol (tahap oksidasi 0 dapat ditemukan di elemen apa pun), bagus +1. Dengan cara ini, agar unit struktural Li3N menjadi netral secara elektrik, nitrogen bertanggung jawab atas induk dari langkah-langkah oksidasi, yaitu -3. Keluar, sebagai hasil dari reaksi, nitrogen telah memperoleh muatan negatif, yang berarti kedatangan elektron. Nitrogen dalam reaksi ini adalah pengoksidasi. Manajer No. 11 Untuk menetapkan posisi antara formula bicara dan reagen, dengan kulit salah satu dari pidato ini dapat digabungkan: ke posisi kulit, ditunjukkan dengan huruf, untuk mengambil posisi yang benar, ditunjukkan dengan angka. D) ZnBr 2 (larutan) 1) AgNO 3, Na 3 PO 4, Cl 2 2) BaO, H 2 O, KOH 3) H2, Cl2, O2 4) HBr, LiOH, CH 3 COOH 5) H 3 PO 4, BaCl 2, CuO Tulis dalam tabel jumlah pidato yang dipilih di bawah huruf yang sesuai. Kesaksian: A-3; B-2; JAM 4; G-1 A) Ketika air seperti gas dilewatkan melalui pencairan sirka, air sirkulasi H 2 S terbentuk: H 2 + S \u003d t o \u003d\u003e H 2 S Ketika klorin dilewatkan di atas belerang yang disesuaikan pada suhu kamar, belerang diklorida dilarutkan: S + Cl 2 \u003d SCl 2 Untuk bangunan EDI tahu pasti bagaimana sirka bereaksi dengan klorin dan tidak perlu merekamnya. Golovnya - pada tingkat memori berprinsip, scho sirka z klorin bereaksi. Klorin adalah zat pengoksidasi kuat, sirka sering menunjukkan fungsi yang mendasarinya - seperti pengoksidasi, jadi memberi energi. Tobto, seperti oksidator kuat, seperti molekul klorin Cl 2, akan teroksidasi. Sirka membakar setengah lampu biru di dekat gas asam dengan bau yang kuat - sulfur dioksida SO 2: B) SO 3 - oksida belerang (VI) dapat dengan jelas menunjukkan kekuatan asam. Untuk oksida semacam itu, reaksi yang paling khas adalah interaksi dengan air, serta dengan oksida dan hidroksida basa dan amfoter. Daftar di bawah nomor 2 termasuk air, oksida basa BaO, dan hidroksida KOH. Ketika oksida asam berinteraksi dengan oksida basa, kekuatan asam asam dan logam terlarut, yang memasuki gudang oksida basa. Untuk oksida asam, asam itu ditambahkan, di mana unsur pembentuk asamnya dapat memiliki tingkat oksidasi yang sama seperti pada oksida. Oksida SO3 diperlakukan dengan asam sulfat H2SO4 (dan di sana, dan di sana tahap oksidasi lebih maju +6). Dengan cara ini, dengan interaksi SO 3 dengan oksida logam, akan ada garam asam sulfat - sulfat, yang akan menggantikan ion sulfat SO 4 2-: SO3 + BaO = BaSO4 Saat berinteraksi dengan air, oksida asam diubah menjadi asam asam: SO 3 + H 2 O \u003d H 2 SO 4 Dan dengan interaksi oksida asam dengan hidroksida logam, kekuatan air asam hidro dilarutkan: SO 3 + 2KOH \u003d K 2 SO 4 + H 2 O C) Seng hidroksida Zn(OH) 2 mungkin memiliki jenis kekuatan amfoter, sehingga bereaksi baik dengan oksida asam dan asam, dan dengan oksida basa natrium. Daftar ini memiliki 4 bachim sebagai asam - HBr dan otsov air bromin, dan padang rumput - LiOH. Mari kita tebak padang rumput apa yang disebut air-hidroksida-logam: Zn(OH)2 + 2HBr = ZnBr2 + 2H2O Zn (OH) 2 + 2CH 3 COOH \u003d Zn (CH 3 COO) 2 + 2H 2 O Zn(OH) 2 + 2LiOH \u003d Li 2 D) Seng bromida ZnBr 2 sіllu, rozchinny v vodі. Untuk garam eceran, reaksi pertukaran ion paling luas. Kekuatan dapat bereaksi dengan kekuatan lain untuk pikiran, bahwa hinaan dari garam vihіdn disebarkan dan pengepungan dilakukan. Juga, ZnBr 2 untuk menghambat ion bromida Br-. Untuk halida logam, merupakan karakteristik bahwa bau bangunan bereaksi dengan halogen Hal 2, yang lebih banyak ditemukan dalam tabel Mendeliev. Dengan pangkat seperti itu? deskripsi jenis reaksi dilanjutkan dari daftar 1: ZnBr 2 + 2AgNO 3 \u003d 2AgBr + Zn (NO 3) 2 3ZnBr 2 + 2Na 3 PO 4 = Zn 3 (PO 4) 2 + 6NaBr ZnBr 2 + Cl 2 = ZnCl 2 + Br 2 Manajer No. 12 Atur posisi antara nama pidato dan kelas / kelompok, ke apa (-ї) pidato harus berbaring: ke posisi kulit, ditandai dengan huruf, pilih posisi yang benar, ditandai dengan angka. Tulis dalam tabel jumlah pidato yang dipilih di bawah huruf yang sesuai. Kesaksian: A-4; B-2; DALAM 1 Penjelasan: A) Metilbenzena sama dengan toluena, tetapi rumus strukturnya adalah: Sedapat mungkin, molekul pidato ini hanya terlipat menjadi karbon dan air, sehingga metilbenzena (toluena) ditambahkan ke karbohidrat B) Rumus struktur anilin (aminobenzena) adalah sebagai berikut: Karena mungkin mengikuti rumus struktur, molekul anilin terdiri dari radikal karbohidrat aromatik (C 6 H 5 -) dan gugus amino (-NH 2), dengan cara ini, anilin dapat ditambahkan ke amina aromatik, tobto . saran yang benar 2. C) 3-metilbutanal. Akhir dari "al" adalah berbicara tentang mereka yang pidatonya naik ke aldehida. Rumus struktural pidato: Manajer No. 13 Dari perelika proponated, bungkus dua pidato, yakі isomer struktural butena-1. Tuliskan nomor pidato yang dipilih di lapangan. Saran: 2; lima Penjelasan: Isomer disebut pidato yang memiliki rumus molekul dan nilai struktural yang sama, yaitu. pidato, yang dibedakan oleh urutan atom, tetapi juga oleh gudang molekul. Manajer No. 14 Dari bungkus perelіku proponated dua kata, dalam kasus interaksi dengan kalium permanganat, akan mungkin untuk mengubah zabarvlennya rozchiny. Tuliskan nomor pidato yang dipilih di lapangan. Saran: 3; lima Penjelasan: Alkana, serta sikloalkana dengan pemuaian cincin dari 5 atom karbon atau lebih, bersifat inert dan tidak bereaksi dengan larutan berair untuk membentuk zat pengoksidasi kuat, seperti, misalnya, kalium permanganat KMnO 4 dan kalium dikromat K 2 Cr 2 O 7. Dengan cara ini, opsi 1 dan 4 jatuh - ketika sikloheksana atau propana ditambahkan ke tingkat air kalium permanganat, tidak akan ada perubahan kontaminasi. Di antara karbohidrat dalam rangkaian homolog benzena, ia pasif terhadap berbagai varietas berair yang hanya mengoksidasi benzena, homolog reshta dioksidasi secara bera dari tengah atau menjadi asam karboksilat, atau menjadi garam higienis. Dalam urutan ini, varian 2 (benzena) jatuh. Yang benar adalah 3 (toluena) dan 5 (propilena). Pidato ofensif mengiritasi warna ungu kalium permanganat melalui reaksi yang berlebihan: CH 3 -CH \u003d CH 2 + 2KMnO 4 + 2H 2 O → CH 3 -CH (OH) -CH 2 OH + 2MnO 2 + 2KOH Manajer No. 15 Dari campuran proponated, bungkus dua kata, dengan reaksi formaldehida. Tuliskan nomor pidato yang dipilih di lapangan. Saran: 3; 4 Penjelasan: Formaldehida dimasukkan ke dalam kelas aldehida - senyawa organik asam, yang dapat membentuk gugus aldehida pada akhir molekul: Reaksi khas aldehida adalah reaksi oksidasi dan pembaruan yang berlangsung di sepanjang gugus fungsi. Di tengah reaksi perubahan formaldehida, reaksi khas adalah pembaruan, seperti air perwakilan (cat. - Pt, Pd, Ni), dan oksidasi - dalam reaksi yang berbeda dari cermin perak. Dengan penambahan air pada katalis nikel, formaldehida diubah menjadi metanol: Reaksi cermin perak adalah reaksi penemuan perbedaan antara amonia oksida perak. Dengan perbedaan dalam amonia berair, oksida sreble berubah menjadi bentuk kompleks - hidroksida diaminaperak (I) OH. Setelah penambahan formaldehida, reaksi pengoksidasi-oksidasi terjadi, dalam hal ini diamati: Manajer 16 Dari campuran proponated, bungkus dua kata, dengan reaksi metilamin. Tuliskan nomor pidato yang dipilih di lapangan. Saran: 2; lima Penjelasan: Metilamin adalah manifestasi paling sederhana dari senyawa organik di kelas amina. Ciri khas amina adalah adanya taruhan elektron yang tidak stabil pada atom nitrogen, setelah amina menunjukkan kekuatan basa dan reaksi memainkan peran nukleofil. Dengan cara ini, sehubungan dengan varian cym iz proponated dari metilamin sebagai basa nukleofil bereaksi dengan klorometana dan asam klorida: CH 3 NH 2 + CH 3 Cl → (CH 3) 2 NH 2 + Cl - CH 3 NH 2 + HCl → CH 3 NH 3 + Cl - Manajer 17 Skema untuk transformasi pidato akan datang: Vznachte, yakі z zaznachenih speechovina speechovina X dan Y. Tulis dalam tabel jumlah pidato yang dipilih di bawah huruf yang sesuai. Saran: 4; 2 Penjelasan: Salah satu reaksinya adalah retensi alkohol dan reaksi hidrolisis haloalkana. Dengan cara ini, dimungkinkan untuk mengambil etanol dari kloroetan dengan meminumnya di padang rumput air yang tersisa - dalam setetes NaOH ini. CH 3 CH 2 Cl + NaOH (aq.) → CH 3 CH 2 OH + NaCl reaksi ofensif reaksi oksidasi etil alkohol. Oksidasi alkohol dilakukan pada katalis tengah atau pada basa tembaga CuO: Manajer 18 Atur posisi antara nama pidato dan produk, yang lebih penting untuk ditetapkan dalam interaksi pidato dengan bromin: ke posisi kulit, ditunjukkan dengan huruf, untuk mengambil posisi kedua, ditunjukkan dengan angka. Tanggapan: 5; 2; 3; 6 Penjelasan: Untuk alkana, reaksi yang paling khas adalah reaksi substitusi radikal bebas, di mana atom air digantikan oleh atom halogen. Dalam urutan ini, brominasi etana dapat dihilangkan brometana, dan bromousing isobutana - 2-bromoisobutana: Hamburan siklus kecil molekul siklopropana dan siklobutana tidak stabil, ketika siklus brominasi molekul-molekul ini melengkung sedemikian rupa, reaksi berlangsung: Atas dasar siklus siklopropana dan siklobutana, siklus sikloheksana dari rosemary besar, setelah itu substitusi atom air untuk atom bromin: Manajer No. 19 Tetapkan perbedaan antara pidato reaktif dan produk yang membalas batu bara, yang diselesaikan dengan interaksi pidato ini: ke posisi kulit, ditunjukkan oleh huruf, untuk mengambil posisi yang benar, ditunjukkan oleh angka. Tuliskan dalam tabel nomor yang dipilih di bawah huruf ganda. Tanggapan: 5; 4; 6; 2 Manajer 20 Dari daftar jenis reaksi yang diusulkan, pilih dua jenis reaksi, yang satu dapat diperkenalkan dalam kombinasi dengan logam genangan air. Tuliskan jumlah jenis reaksi yang dipilih di lapangan. Saran: 3; 4 Kumpulan logam (Li, Na, K, Rb, Cs, Fr) berujung di subgrup utama grup I Tabel D.I. Pengikut Mendeliev, dengan mudah mentransmisikan elektron, menyebar secara merata. Jika logam genangan air dilambangkan dengan huruf M, maka reaksi logam genangan dengan air dapat dilihat sebagai berikut: 2M + 2H2O → 2MOH + H2 Genangan itu bahkan lebih aktif ketika diperpanjang ke air. Reaksi berjalan bergejolak dari visi nomor yang bagus panas, tidak dapat dibalik dan tidak mengubah katalis (non-katalitik) - ucapan, yang akan mempercepat reaksi dan tidak memasuki gudang produk reaksi. Secara signifikan, bahwa semua reaksi eksotermik tidak mengubah katalis dan berlangsung tanpa dapat ditarik kembali. Pecahan logam dan air adalah ucapan, yang dalam penggilingan agregat yang berbeda, di mana reaksi berlangsung antar fase, juga heterogen. Jenis reaksinya adalah substitusi. Reaksi antara pidato anorganik dibawa ke reaksi substitusi, sebagai akibatnya pidato sederhana dilipat dan sebagai akibatnya pidato sederhana dan dilipat lainnya diselesaikan. (Reaksi netralisasi berlangsung antara asam dan basa, sebagai akibatnya ucapan ditukar dengan bagian-bagian gudangnya dan menjadi ucapan yang lebih kuat dan kurang terdisosiasi). Seperti yang dikatakan di atas, genangan air dilemparkan oleh para penjelajah, mengeluarkan elektron dari bola terluar, dan reaksinya adalah oksidasi dan oksidasi. Manajer 21 Dari remix proponated infus ovnishnіh, bungkus dua infus, seolah-olah untuk mengubah kecepatan reaksi etilen dengan air. Tuliskan nomor panggilan yang dipilih di bidang. Saran: 1; 4 untuk swedia reaksi kimia tambahkan faktor-faktor seperti: mengubah suhu dan konsentrasi reagen, serta variabel katalis. Sesuai dengan aturan empiris Van't Hoff, ketika suhu pada kulit naik 10 derajat, konstanta keseragaman reaksi homogen meningkat 2-4 kali. Juga, ubah suhu untuk mengurangi kecepatan reaksi. Pilihan pertama adalah berjalan kaki. Seperti yang ditandai lebih tinggi, kecepatan reaksi ditambahkan dan konsentrasi reagen diubah: jika konsentrasi etilena meningkat, maka pertumbuhan dan kecepatan reaksi, yang tidak membantu tanaman. Dan perubahan konsentrasi air - komponen aktif, di sisi lain, mengurangi kecepatan reaksi. Juga, opsi lain tidak cocok, tetapi opsi keempat cocok. Pidato adalah katalis, yang akan mempercepat kecepatan reaksi kimia, tetapi tidak masuk ke gudang produk. Perubahan katalis akan mempercepat reaksi hidrogenasi etilen, yang juga tidak menunjukkan pikiran tanaman, itu bukan cara yang benar. Ketika etilen berinteraksi dengan air (pada katalis Ni, Pd, Pt), etana larut: CH 2 \u003d CH 2 (g) + H 2 (g) → CH 3 -CH 3 (g) Semua komponen yang dimiliki reaksi, dan produknya adalah rhechovin seperti gas, juga, tekanan sistem juga dipengaruhi oleh kecepatan reaksi. Untuk dua kali, etilen dikonsumsi, dan satu air dipenuhi, dan kemudian, reaksi terhadap perubahan tekanan dalam sistem. Mendorong tekanan, kami akan mempercepat reaksi. P'yata vіdpovіd tidak datang. Manajer 22 Untuk menetapkan perbedaan antara formula garam dan produk dengan elektrolisis larutan garam, seperti yang terlihat pada elektroda inert: ke posisi kulit, Formula garam PRODUK ELEKTROLISIS Tuliskan dalam tabel nomor yang dipilih di bawah huruf ganda. Saran: 1; 4; 3; 2 Elektrolisis adalah proses pengoksidasi dan pengoksidasi yang terjadi pada elektroda selama aliran listrik konstan melalui pembukaan dan pencairan elektrolit. Pada katoda, penting untuk dicatat adanya kation yang tenang, yang mungkin memiliki aktivitas oksida terbesar. Pada anoda pada awalnya, anion tersebut teroksidasi, seolah-olah mereka bisa menjadi bangunan yang paling penting. Elektrolisis air 1) Proses elektrolisis variasi air pada katoda tidak boleh diendapkan menurut bahan katoda, melainkan diendapkan menurut posisi kation logam dalam rangkaian tegangan elektrokimia. Untuk kation berturut-turut Proses perpanjangan Li + - Al 3+: 2H 2 O + 2e → H 2 + 2OH - (H 2 terlihat di katoda) Zn 2+ - Pb 2+ Proses renovasi : Me n + + ne → Me 0 ta 2H 2 O + 2e → H 2 + 2OH - (H 2 ta Me dapat dilihat pada katoda) Cu 2+ - Au 3+ proses pembaharuan Me n + + ne → Me 0 (me terlihat pada katoda) 2) Proses elektrolisis beda air pada anoda akan diendapkan sesuai dengan bahan anoda dan sifat anion. Seperti anoda tidak terbuka, tobto. inert (platinum, emas, vugilla, grafit), maka prosesnya basi hanya pada sifat anion. Untuk anion F -, SO 4 2-, NO 3 -, PO 4 3-, OH - proses oksidasi: 4OH - - 4e → O 2 + 2H 2 O atau 2H 2 O - 4e → O 2 + 4H + (oksigen terlihat pada anoda) ion halida (krim F-) proses oksidasi 2Hal - - 2e → Hal 2 ) organik proses oksidasi asam: 2RCOO - - 2e → R-R + 2CO 2 Benar-benar sama dengan listrik: A) selisih antara Na 3 PO 4 2H 2 O → 2H 2 (di katoda) + O 2 (di anoda) B) selisih KCl 2KCl + 2H 2 O → H 2 (di katoda) + 2KOH + Cl 2 (di anoda) C) perbedaan antara CuBr2 CuBr 2 → Cu (pada katoda) + Br 2 (pada anoda) D) distribusi Cu(NO3)2 2Cu (NO 3) 2 + 2H 2 O → 2Cu (pada katoda) + 4HNO 3 + O 2 (pada anoda) Manajer 23 Atur perbedaan antara nama garam dan pengaturan nilai garam untuk hidrolisis: ke posisi kulit, ditunjukkan dengan huruf, pilih posisi yang benar, ditunjukkan dengan angka. Tuliskan dalam tabel nomor yang dipilih di bawah huruf ganda. Saran: 1; 3; 2; 4 Hidrolisis garam - interaksi garam dengan air, yang mengarah pada penambahan kation air H + molekul air ke anion asam berlebih dan (atau) gugus hidroksil OH - molekul air ke kation logam. Hidrolisis dilakukan oleh garam jenuh dengan kation, yang cocok untuk basa lemah, dan anion, yang cocok untuk asam lemah. A) Amonium klorida (NH 4 Cl) - kuat, dibuat dengan asam klorida kuat dan amonia (basa lemah), dapat dihidrolisis oleh kation. NH 4 Cl → NH 4 + + Cl - NH 4 + + H 2 O → NH 3 H 2 O + H + (larut dalam air amonia) Bagian tengah bersifat asam (pH< 7). B) Kalium sulfat (K 2 SO 4) - kuat, dibuat dengan asam sulfat kuat dan kalium hidroksida (padang rumput, yang merupakan basa kuat), hidrolisis tidak diperbolehkan. K 2 SO 4 → 2K + + SO 4 2- C) Natrium karbonat (Na 2 CO 3) - kekuatan, dibuat dengan asam karbonat lemah dan natrium hidroksida (padang rumput, yang merupakan basa kuat), dapat dihidrolisis oleh anion. CO 3 2- + H 2 O → HCO 3 - + OH - (penerangan ion hidrokarbonat yang terdisosiasi lemah) Bagian tengah genangan (pH>7). D) Aluminium sulfida (Al 2 S 3) - kekuatan, ditempa dengan asam sirkovodnoy lemah dan aluminium hidroksida (basa lemah), tunduk pada hidrolisis lengkap dengan sukrosa aluminium hidroksida dan sirvodnya: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 + 3H 2 S Bagian tengah mendekati netral (pH ~ 7). Manajer 24 Untuk menetapkan perbedaan antara reaksi kimia yang sama dan penggunaan langsung pemerataan kimia dengan peningkatan tekanan dalam sistem: ke posisi kulit, ditunjukkan dengan huruf, untuk mengambil posisi kedua, ditunjukkan dengan angka. REAKSI REAKSI A) N 2 (g) + 3H 2 (g) 2NH 3 (g) B) 2H 2 (g) + O 2 (g) 2H 2 O (g) C) H2 (g) + Cl2 (g) 2HCl (g) D) SO 2 (g) + Cl 2 (g) SO 2 Cl 2 (g) DESAIN LANGSUNG RIVNOVAGI KIMIA 1) pergeseran dari reaksi langsung 2) zm_shchuєtsya pada reaksi bik zvorotnoї 3) tidak ada perubahan cemburu Tuliskan dalam tabel nomor yang dipilih di bawah huruf ganda. Kesaksian: A-1; B-1; Di 3; G-1 Reaksi dikenal dalam rasio kimia, jika tingkat keparahan reaksi langsung lebih tinggi daripada tingkat keparahan serum. Usunennya ryvnovagi pada yang membutuhkan langsung mencapai perubahan pikiran reaksi. Pejabat yang menandatangani posisi cemburu: - keburukan: zbіlshennya wakil zmіschuє rіvnovag pada reaksi bіk, scho menyebabkan perubahan volume - suhu: kenaikan suhu dan offset pemerataan reaksi endotermik - konsentrasi produk ucapan dan reaksi eksternal: peningkatan konsentrasi ucapan eksternal dan peningkatan konsentrasi produk ucapan eksternal dan peningkatan produk reaksi dari reaksi langsung - Katalis tidak meludahi adopsi kecemburuan, melainkan mempercepat pencapaian A) Pada tahap pertama, reaksi berubah karena perubahan, penskalaan V (N 2) + 3V (H 2)\u003e 2V (NH 3). Mendorong tekanan pada sistem, itu sama dengan membalas pembunuhan dari pidato yang kurang umum, kemudian, secara langsung (pembunuhan reaksi langsung). B) Dengan cara lain, reaksinya sama untuk perubahan, skalanya adalah 2V (H2) + V (O2) > 2V (H2O). Mendorong tekanan pada sistem, menyamakan tekanan pada reaksi langsung (pada produk). c) Pada saat yang sama, waktu reaksi tidak berubah, karena V (H 2) + V (Cl 2) \u003d 2V (HCl), tidak ada bias yang sama. D) Pada tahap keempat, reaksinya juga sama dengan perubahan, skalanya adalah V(SO2) + V(Cl2) > V(SO2Cl2). Mendorong tekanan pada sistem, menyamakan tekanan pada produk (reaksi langsung). Manajer 25 Atur perbedaan antara formula pidato dan reagen, untuk bantuannya Anda dapat memisahkan perbedaan air: ke posisi kulit, ditandai dengan huruf, pilih posisi yang benar, ditandai dengan angka. FORMULA Pidato A) HNO3 dan H2O C) NaCl dan BaCl 2 D) AlCl3 dan MgCl2 Tuliskan dalam tabel nomor yang dipilih di bawah huruf ganda. Kesaksian: A-1; B-3; Di 3; G-2 A) Asam nitrat dan air dapat dipisahkan untuk garam tambahan - kalsium karbonat CaCO3. Kalsium karbonat tidak berbeda dalam air, tetapi ketika berinteraksi dengan asam nitrat, itu membuat perbedaan dalam kekuatan - kalsium nitrat Ca (NO 3) 2 yang dengannya reaksi disertai dengan penglihatan karbon dioksida bebas tekanan: CaCO 3 + 2HNO 3 → Ca(NO 3) 2 + CO 2 + H 2 O B) Kalium klorida KCl dan NaOH padang rumput dapat dipisahkan dengan berbagai midi sulfat (II). Dalam interaksi midi (II) sulfat dengan KCl, reaksi pertukaran tidak berlangsung, ion K +, Cl -, Cu 2+ dan SO 4 2- hadir dalam berbagai derajat, mereka sedikit larut satu dengan satu disosiasi rendah pidato. Dalam interaksi midi(II) sulfat dengan NaOH, terjadi reaksi pertukaran, menghasilkan pengendapan midi(II) hidroksida (dasar warna blackite). C) Natrium klorida NaCl dan barium BaCl 2 - garam eceran, serta midi sulfat eceran (II). Dalam interaksi midi (II) sulfat dengan NaCl, reaksi pertukaran tidak berlangsung, ion Na +, Cl -, Cu 2+ dan SO 4 2- hadir dalam berbagai derajat, mereka tidak banyak melarutkan satu dengan satu rendah -ucapan disosiasi Ketika mengganggu midi(II) sulfat dan BaCl 2, reaksi pertukaran terjadi, menghasilkan pengendapan barium sulfat BaSO 4 . D) Aluminium klorida AlCl 3 dan magnesium MgCl 2 berbeda dalam air dan berperilaku berbeda ketika berinteraksi dengan kalium hidroksida. Magnesium klorida dari padang rumput mengatur pengepungan: MgCl 2 + 2KOH → Mg(OH) 2 + 2KCl Saat berinteraksi dengan padang rumput dengan aluminium klorida, endapan terbentuk, yang kemudian berbeda dari garam kompleks terlarut - kalium tetrahidroksoaluminat: AlCl3 + 4KOH → K + 3KCl Manajer 26 Atur posisi antara area bicara dan area stosuvannya: ke posisi kulit, ditunjukkan dengan huruf, pilih posisi yang benar, ditunjukkan dengan angka. Tuliskan dalam tabel nomor yang dipilih di bawah huruf ganda. Kesaksian: A-4; B-2; Di 3; G-5 A) Ammiac adalah produk paling penting dari industri kimia, dan produksinya lebih dari 130 juta ton per sungai. Pada dasarnya, amonia kuat dengan adanya aditif nitrogen (amonium nitrat dan sulfat, sechovin), minuman keras, pidato vibukhovy, asam nitrat, soda. Bagian tengah dari varian vidpovidey yang didukung oleh bidang stagnasi amonia dan virobnitstvo dobriv (varian keempat dari vіdpovіdі). B) Metana adalah karbohidrat paling sederhana, perwakilan lapisan batas rendah yang paling stabil secara termal. Yogo secara luas vikoristovuyut seperti pobutov dan promislova, serta sirovini untuk promyslovnosti (varian lain dari vіdpovid). Metana untuk 90-98% gudang gas alam. C) Karet adalah nama yang diberikan untuk bahan yang terobsesi dengan polimerisasi dengan hasil memperoleh ikatan subtraktif. Izopren dapat dibawa ke jenis ini dengan titik koma dan menang untuk pemilihan satu jenis karet: D) Alkena dengan berat molekul rendah digunakan untuk plastik, sedangkan pemenang etilen untuk plastik yang disebut polietilen: n CH 2 \u003d CH 2 → (-CH 2 -CH 2 -) n Manajer No. 27 Hitung berat kalium nitrat (dalam gram), sebagai berikut: dalam 150 g, perbedaan dengan fraksi massa garam adalah 10%, untuk kandungan, perbedaannya adalah dengan fraksi massa 12%. (Tuliskan angka ke sepuluh terdekat.) Nilai: 3,4 g Penjelasan: Biarkan x g - masa potasium nitrat, yak rozchinyayat 150 g razchinya. Kami menghitung massa kalium nitrat, dibagi menjadi 150 g: m(KNO 3) \u003d 150 g 0,1 \u003d 15 g Untuk menambahkan 12% fraksi massa garam, tambahkan x g kalium nitrat. Masa dilipat perbedaan di tsioma (150 + x) r. Rivnyannya akan tertulis pada pandangan: (Tuliskan angka ke sepuluh terdekat.) Video: 14,4 g Penjelasan: Sebagai hasil dari spalling berulang dari air sirkulasi, sulfur dioksida dan air dilarutkan: 2H 2 S + 3O 2 → 2SO 2 + 2H 2 O Menurut hukum Avogadro, mereka yang terobsesi dengan gas, yang memiliki pikiran yang sama, terlihat satu lawan satu seperti jumlah gas ini. Dalam urutan ini, untuk reaksi yang sama: (O 2) = 3/2ν(H 2 S), untuk selanjutnya, obsyagi sіrkovodnya dan sourness spіvvіdnosya di antara mereka sendiri seperti ini: V (O 2) \u003d 3 / 2V (H 2 S), V (O 2) \u003d 3/2 6,72 l \u003d 10,08 l, bintang V (O 2) \u003d 10,08 l / 22,4 l / mol \u003d 0,45 mol Mari kita hitung massa asam, kebutuhan spalling baru dari sirkovodnya: m(O 2) \u003d 0,45 mol 32 g / mol \u003d 14,4 g Manajer 30 Metode keseimbangan elektronik Vikoristovuyuchi, lipat reaksi yang sama: Na 2 SO 3 + ... + KOH → K 2 MnO 4 + ... + H 2 O Vznachte okislyuvach dan vіdnovnik. Mn +7 + 1e → Mn +6 2 reaksi pembaruan S +4 2e → S +6 1 reaksi oksidasi Mn +7 (KMnO 4) - zat pengoksidasi, S +4 (Na 2 SO 3) - pembawa Na 2 SO 3 + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O Manajer 31 Zalizo diperbaiki dengan asam sulfat pekat panas. Kekuatan Otriman overdosis dengan natrium hidroksida. Pengepungan badai Vipav disaring dan digoreng. Pidato Otriman memanas karena kedinginan. Tulis daftar beberapa deskripsi reaksi. 1) Zalizo, seperti aluminium dan kromium, tidak bereaksi dengan asam sulfat pekat, melengkung dengan peleburan oksida asam. Reaksi hanya terjadi ketika dipanaskan dengan melihat gas asam: 2Fe + 6H 2 SO 4 → Fe 2 (SO 4) 2 + 3SO 2 + 6H 2 O (bila dipanaskan) 2) Sulfat saline (III) - larut dalam air, masuk ke dalam reaksi pertukaran dengan padang rumput, akibatnya hidroksida air liur (III) jatuh ke dalam pengepungan (warna semi-coklat): Fe 2 (SO 4) 3 + 3NaOH → 2Fe(OH) 3 + 3Na 2 SO 4 3) Logam hidroksida yang tidak larut, ketika dipanggang, terurai menjadi oksida reaktif dan air: 2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O 4) Ketika memanaskan oksida (III) dengan garam logam, oksida garam (II) dilarutkan (padatan dalam FeO mungkin memiliki tahap oksidasi menengah): Fe 2 O 3 + Fe → 3FeO (bila dipanaskan) Manajer 32 Tulis reaksi yang sama, untuk bantuan yang Anda dapat membuat transformasi seperti itu: Di bawah jam menulis reaksi yang sama, formula struktural vikoristovyte pidato organik. 1) Dehidrasi intramolekul terjadi pada suhu yang lebih tinggi dari 140 o C. Akibatnya, pemecahan atom air dari atom karbon ke alkohol, naik melalui satu ke alkohol hidroksida (dalam posisi ). CH 3 -CH 2 -CH 2 -OH → CH 2 \u003d CH-CH 3 + H 2 O (cuci - H 2 SO 4, 180 o C) Dehidrasi antarmolekul berlangsung pada suhu di bawah 140 o C dengan asam disulfat dan menyebabkan pemecahan satu molekul air menjadi dua molekul alkohol. 2) Propilen dapat ditambahkan ke alkena yang tidak simetris. Ketika hidrogen halida ditambahkan dan atom air ditambahkan ke atom karbon pada ikatan rangkap, dihubungkan dengan sejumlah besar atom di dalam air: CH 2 \u003d CH-CH 3 + HCl → CH 3 -CHCl-CH 3 3) Dengan larutan berair NaOH untuk 2-kloropropana, atom halogen digantikan oleh gugus hidroksil: CH 3 -CHCl-CH 3 + NaOH (aq.) → CH 3 -CHOH-CH 3 + NaCl 4) Propilen dapat dihilangkan tidak hanya dari propanol-1, tetapi juga dari propanol-2 melalui reaksi dehidrasi intramolekul pada suhu lebih dari 140 o C: CH 3 -CH (OH) -CH 3 → CH 2 \u003d CH-CH 3 + H 2 O (cuci H 2 SO 4, 180 o C) 5) Dalam media genangan, diencerkan dengan kalium permanganat berair, hidroksilasi alkena dengan diol yang disetujui diamati: 3CH 2 \u003d CH-CH 3 + 2KMnO 4 + 4H 2 O → 3HOCH 2 -CH (OH) -CH 3 + 2MnO 2 + 2KOH Manajer 33 Fraksi massa yang signifikan (%) garam sulfat (II) dan aluminium sulfida dalam jumlah, tetapi ketika menguji 25 g jumlah dengan air, terlihat gas, yang lebih mungkin bereaksi dengan 960 g sulfat 5% midi (II) . Anda harus menuliskan jumlah reaksi yang sama, yang ditugaskan untuk tugas mental, dan kemudian menambahkan perhitungan yang diperlukan (tunjukkan unit variasi kuantitas fisik yang bercanda). Validasi: (Al 2 S 3) = 40%; (CuSO 4) = 60% Saat memproses jumlah garam (II) sulfat dan aluminium sulfida dengan air, sulfat hanya dipisahkan, dan sulfida dihidrolisis dengan aluminium (III) hidroksida dan air: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 + 3H 2 S (I) Ketika melewati sirvodnya melalui rosen sulfat midi (II), endapan sulfida midi (II) rontok: CuSO 4 + H 2 S → CuS + H 2 SO 4 (II) Kami menghitung massa dan kuantitas pidato campuran midi(II) sulfat: m (CuSO 4) \u003d m (p-ra) (CuSO 4) \u003d 960 g 0,05 \u003d 48 g; (CuSO 4) \u003d m (CuSO 4) / M (CuSO 4) \u003d 48 g / 160 g \u003d 0,3 mol Untuk reaksi yang sama (II) (CuSO 4) \u003d (H 2 S) \u003d 0,3 mol, dan untuk reaksi yang sama (III) (Al 2 S 3) \u003d 1 / 3ν (H 2 S) \u003d 0, 1 mol Mari kita hitung massa aluminium sulfida dan midi (II) sulfat: m(Al 2 S 3) \u003d 0,1 mol 150 g / mol \u003d 15 g; m(CuSO4) = 25 g - 15 g = 10 g (Al 2 S 3) \u003d 15 g / 25 g 100% \u003d 60%; (CuSO 4) \u003d 10 g / 25 g 100% \u003d 40% Manajer 34 Ketika spalyuvannі zrazka deyakoї organії setengah massa 14,8 g diambil 35,2 g karbon dioksida dan 18,0 g air. Rupanya, jelas bahwa uap pidato lebih umum 37. Selama studi tentang kekuatan kimia pidato, ditetapkan bahwa ketika menghubungkan pidato dengan midi(II) oksida, keton dilarutkan. Berdasarkan data ini, pikirkan tugas: 1) menghitung angka-angka yang diperlukan untuk pembentukan rumus molekul pidato organik (menunjukkan unit variasi kuantitas fisik yang bercanda); 2) tuliskan rumus molekul dari pidato organik; 3) menjumlahkan rumus struktural dari baris bicara, sehingga secara jelas mencerminkan urutan ikatan atom-atom dalam molekul pertama; 4) tuliskan reaksi yang sama dari pidato dengan midi(II) oksida, rumus struktur vicorist pidato. Hasil tidak lebih rendah dari jumlah minimum bola yang ditetapkan, memberikan hak untuk masuk universitas di spesialisasi, de subjek kimia. VNZ tidak berhak menetapkan ambang batas minimum untuk bahan kimia di bawah 36 poin. Universitas bergengsi, sebagai suatu peraturan, menetapkan ambang batas minimum mereka sendiri untuk kekayaan. Itu sebabnya, untuk tujuan belajar di sana, siswa tahun pertama mungkin memiliki pengetahuan yang lebih baik. Di situs web resmi FIPI, opsi untuk DE dalam kimia dipublikasikan secara luas: demonstrasi, periode pra-stroke. Pilihan yang sama memberikan pernyataan tentang struktur masa depan tidur dan tingkat lipat hari dan dzherelami informasi yang dapat diandalkan saat mempersiapkan . Pada varian DI z khіmії 2017, tahun 2017 diubah dari KІM tahun 2016 lalu, untuk itu perlu mempersiapkan versi saat ini, dan untuk berbagai pengembangan lulusan kemenangan, untuk mengubah varian dari tahun-tahun terakhir. Bahan dan barang tambahan Bahan-bahan berikut ditambahkan ke varian kulit robot pemeriksaan DI z chemiї: sistem periodik unsur kimia D.I. Mendelev; tabel garam, asam dan basa dalam air; seri elektrokimia tegangan logam. Di bawah jam penilaian pekerjaan ujian, diperbolehkan untuk menguji kalkulator non-pemrograman. Transfer tambahan dan materi tambahan, yang diizinkan di EDI, dikonfirmasi oleh perintah Kementerian Pendidikan Rusia. Bagi yang ingin melanjutkan pendidikan di universitas, pilihan mata kuliah di bulan Mei, tergantung pilihan tes masuk untuk spesialisasi yang dipilih Perubahan ujian masuk di universitas untuk semua spesialisasi (pelatihan langsung) ditunjuk atas perintah Kementerian Pendidikan dan Ilmu Pengetahuan Ukraina. Kulit janji awal yang lebih besar dipilih dari transfer pertama dari mereka dan benda-benda lain, yang menunjukkan bahwa saya akan menerima dalam aturan saya sendiri. Penting untuk membiasakan diri dengan informasi di situs web negara-negara yang dipilih, pertama-tama ajukan aplikasi untuk berpartisipasi dalam EDI dari transfer mata pelajaran yang sama.FORMULA Pidato
REAGENTI
Versi prestrokovy dari DI z khimiї 2017 rіk
Riko
Dapatkan varian pra-string
2017
varianpo himii
2016
mengambil keuntungan
Versi demonstrasi DI z khіmії 2017
Opsi zavdan + vіdpovіdі
Dapatkan opsi demo
Spesifikasi
varian demo himiya ege
pengkode
pengkode
(Persiapan langsung).