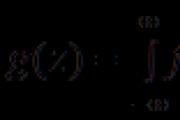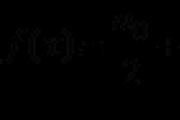Mėlynųjų dujų tūris cheminėse reakcijose. Avogadro dėsnis
Į dujas panaši kalbos stovykla. Avogadro dėsnis. Molinis dujų tūris.
Kalbą galima perdirbti trijuose agregatų malūnuose – kietojo, reto ir dujinio. Dalys, tame skaičiuje, formuojasi vientisa kalba, kad ji būtų mіtsno pov'yazanі tarpusavyje, iki tos kietos kalbos, jos sudaro vieną formą. Kietųjų kūnų dalys gali būti atomai, molekulės, jonai, kurie sudaro kristalines struktūras. Qi chastki kolivayutsya su maža amplitudės plakimas vuzlіv kristalinis ґrat. Gimtuosiuose regionuose dalys yra susietos viena su kita silpniau ir gali būti per daug aprengtos, kad būtų pasiektas didelis skirtumas. Dėl šios priežasties plinistas ir išsipučia teisėjų formos, kuriose žinomas smarvė.
Kaitinant retai pastebimas kalbos perėjimas iš kietosios būsenos, todėl dalelių skilimo amplitudė palaipsniui didėja. Kai temperatūra aukšta, kalbos dalelės išsipučia su zdatnost, užgožia burbuliukų mazgus, stebimas tirpimas. Atšalę navpaki, rіdini dalys praleidžia zdatnіst juda ir užsifiksuoja dainavimo padėtyje, todėl kalba tampa tvirta. Didžiausiems protams rіdini, kaip taisyklė, vargina molekulinį gyvenimą. Esant aukštai temperatūrai, ridini struktūra gali būti skirtinga (druskų ir metalų lydymas).
Sąveika tarp molekulių gausiai silpna, mažesnė tarp jonų joninėse kristalų struktūrose; kovalentiniu ryšiu susieti atomai atominėse struktūrose; metalo jonai, surišti elektronų dujomis metalinėse konstrukcijose.
Tvirta ir reta kalbų stovykla drąsiai išgarsinti kondensacinis malūnas. Kalbos storis kondensuotame pliene pasikeičia maždaug 0,5–22,5 g / cm3 ribose. Kalba į degalinę panašioje stotyje gali būti žymiai mažesnė - arti 10 -2 - 10 -3 g / cm 3. Perėjimą prie dujinio malūno sukelia kalbų, kurios yra kondensuotame malūne, kaitimas (kietųjų medžiagų virinimas, kietų kalbų sublimacija). Panašūs į dujas didžiausiems kalbos protams sudaro molekulės.
Pereinant į dujas panašią būseną, kalbos dalelės prideda tarpmolekulinės sąveikos jėgų. Obsyag, kuris užima dujas, o tai iš tikrųjų užstoja laisvą erdvę tarp dujų molekulių, kurios atsitiktinai žlunga. Šios erdvės dydį lemia temperatūra ir yda. Kai mes obsyagom, užimti pačių molekulių, mes galime maištauti. žvaigždės rėkia Avogadro dėsnis :
Vienodai skirtingų dujų įsipareigojimai turi tą patį molekulių skaičių tiems patiems protams.
Іz Avogadro riksmo įstatymas dvi pagrindinės išvados .
Pirmoji pasekmė
Vienas molis bet kokių dujų tiems patiems protams skolinasi tą patį įkeitimą. Tsey obsyag vadinamas molinis dujų slėgis ( V m ) , Kuris yra vimiryuetsya m 3 / mol (dažnai dm 3 / mol). Molinė prievolė dujoms yra pažangesnė, kad įpareigotų dujas tokį patį kiekį:
Vіdomo, scho vertė V m įkristi į vіd protus (temperatūra, tysk). Norint atlikti užduotį, reikia atsiminti V m at reikšmę normalus protas (n.o.s.) - atmosferos slėgis (101,3 kPa) ir ledo temperatūra (0 0 C arba 273,15 K).
Normaliam protui V m \u003d 22,4 dm 3 / mol, arba
CI vienetais 0,0224 m 3 / mol.
Dar viena pasekmė
Dujų pločiai (arba tų pačių dujų masės) sudedami kaip dujų molinės masės.
Tai matosi iš tokių veidrodžių. Įneškite dvi porcijas skirtingų dujų to paties įsipareigojimo (vimiriečių įsipareigojimai tiems patiems protams). Mes juos žinome:
їх masės nustatymas:
Jakščo vikoristovuvat schilnіst:
Už Avogadro dėsnio n 1 \u003d n 2 žr.
Dujų storio pokytis, kuris brangesnis keičiantis molinėms masėms, vadinamas Vienų dujų talpa kitoje ( D ). D – reikšmė neapibrėžta.
Žinant D ir vienų dujų molinę masę, nesunku sužinoti kitų dujų molinę masę:
; M1 = M2 × D.
taikyti
M(x) = M(H2) × D = 2 × 8,5 = 17 g/mol
Dujos iš tokios molinės masės – amoniakas NH 3 .
Tam tikro į dujas panašių angliavandenių stiprumas bus parodytas brangesnis dviems. Pakeiskite savo molinę masę į angliavandenius.
Atrodo, kad vidutinė molinė masė yra 29 g/mol.
M(x) = M(p.) × D = 29 × 2 = 58 g/mol
Tokios molinės masės angliavandeniai yra Z 4 H 10 butanas.
Atkreipkite dėmesį, kad dujos, kurių molinė masė mažesnė nei 29, yra lengvos per vieną pakartojimą, svarbu daugiau nei 29.
Rozrahunkovyh augaluose gali būti duomenų apie azotą, rūgštingumą ir kitas dujas. Šiuo atveju molinės masės reikšmei reikia klampų storį padauginti iš molinės masės, panašiai kaip azoto (28 g/mol), rūgštaus (32 g/mol) ir kt.
Avogadro dėsnis plačiai naudojamas cheminiuose tyrimuose. Oskilki dujoms yra proporcingi kalbų skaičiui, tada koeficientai lygiomis reakcijomis, kurie atspindi reaguojančių kalbų skaičių, proporcingi trukdančių dujų proporcijoms. Akivaizdu, kad scho obsyagi mayut bet vimiryan tiems patiems protams.
užpakalis
Kažkokios rūgštelės reikės 2 dm atskilimui 3 propanas? Vymiryan obyagi už n. y.
H 3 H 8 + 5O 2 3CO 2 + 4H 2 O.
Iš Avogadro dėsnio aišku, kad vienodas skirtingų dujų skaičius turi būti lygus tam pačiam skaičiui molekulių ir, be abejo, tokiam pat skaičiui kalbos molių. Gaukime propaną iki 1 dm3. Todi, iš vienodos reakcijos, 1 dm 3 propano nuplikymui reikia 5 dm 3 rūgštaus, o 2 dm 3 (du litrų) - 10 dm 3 Pro 2.
Chemija
Pasaulinė chemija
Pagrindinės chemijos sąvokos, dėsniai ir teorijos
Mėlynųjų dujų tūris cheminėse reakcijose. Avogadro dėsnis
Gay-Lussac pinigų dėsnis
Gaziai vieni su kitais reaguoja į bendrinės kalbos dainas. 1808 metais p. J. L. Gay-Lussac nustatęs tokią taisyklę: Dujų kiekis, patenkantis į reakciją, gali būti matomas kaip mažas skaičius..
Vіdkritiy vchenim vіdomy dėsnis chemijoje jakas tūrių dėsnis b. Jogai būtina, kad reakcijoje dalyvaujančios dujos būtų tokios pačios temperatūros ir slėgio.
Vіdnoshennya obsyagіv gazіv, scho patekti į cheminę reakciją, vіdpovіdat koeficientai lygūs, pavyzdžiui: .
Šiuo atveju 3 tūriai vandens reaguoja su 1 tūriu azoto, dėl to ištirpsta 2 tūriai amoniako, todėl parodomas spontaniškumas.
Vadovas. Kokia reikalinga vandens reakcija 2 m 3 azoto?
Sprendimas
Iš vienodos reakcijos matyti, kad kaltas vandens tūris, bet 3 kartus didesnis azoto tūris:
obsyag vandens m3.
Avogadro dėsnis
Norėdami paaiškinti paprastą spіvvіdnoshenі mіzh vzyagyah reaguojančias dujas vikoristovuyut Avogadro dėsnį: Vienodos skirtingų dujų ryšiai tiems patiems protams (temperatūra ir slėgis) turi tą patį molekulių skaičių.Aš neleidau Avogadro dėsniui du kartus išgirsti ta:
1) Vienas molis bet kokios rūšies dujų tiems patiems protams skolinasi tą patį įsipareigojimą.
Normaliam protui (n.a.), tada esant 273 K temperatūrai ir 101,3 kPa (1 atm) slėgiui, 1 molis bet kokių dujų užima tūrį, lygų 22,4 litro. Tsei obsyag skambutis molinės dujos i reiškia l/mol.
Molinį ryšį galima atlaisvinti pagal formulę
.
2) Esant pastoviam slėgiui, ta dujų tarpo temperatūra yra mažesnė nei viena molinė masė.
Tse leidžia neteisingai suprasti pralaidus storis pirmas dujas kitu būdu:
,
de D- matomai šilniškas, kaip rodo, tuo pačiu pirmas dujas svarbus kitam tiems patiems protams.
Dažniausiai vikoristas gali matyti vandenį per dujas. Todi:
; .
Bet kokioms dujoms galima atlaisvinti storą tankmę.
Kieno vikoristano medžiagų platinimas metodinis asistentas„Navchannya rozvyazannyu chemijos problemos“. Autoriai – administratoriai: aukščiausios kategorijos chemijos mokytojas, Švietimo įstaigos „Gardino 1 gimnazija“ metodininkas Tolkachas L.Ya.; vadovo-metodinio skyriaus metodininkė Sukurti išsilavinimą „Grodno OIPK ir PRR ir SV“ Korobova N.P.
Dujų molinių tūrių skaičiaus apskaičiavimas.
Iškiliojo dujų tankio apskaičiavimas.
Mėlynųjų dujų tūris
Vienas molis bet kokios rūšies dujų tiems patiems protams užima tą patį. Taigi, normaliam protui (n.o.),tobto. 0 °C temperatūroje ir normalus atmosferos slėgis, kuris yra 101,3 kPa, vienas molis bet kokių dujų užima tūrį22,4 dm3.
NustatymasAš įpareigoju dujas iki tam tikro cheminio kalbos kiekio – vertės, kaip ji vadinamamolinis dujų slėgis (Vm):
Vm = V/ ndm 3, žvaigždutėsV = Vm · n
Norint pasirinkti: lengviausios ar svarbiausios dujos yra lygios kitoms dujoms, pakanka išlyginti jų storį:
r 1 / r 2 = M 1 V 1 / M 2 V 2 = M 1 / M 2 = D 2.Sukelto virazo požiūriu aišku: išlyginti dujų plotį, pasiekti jų molinių masių išlyginimą.
Vienų dujų molinės masės ir kitų dujų molinės masės santykis yra reikšmė, kaip ji vadinama
suvokiama erdvė ( D 2 ) vienos dujos su kitomis dujomis.Žinodami vienos dujų stiprumą kitose, galite apskaičiuoti molinę masę:
M
1 = M 2 · D 2 .Jei matote dujų sumą, tada ši „molinė masė“ yra lygi 22,4 litro tūrio masei. Tsya vertė yra skaitine prasme tobulesnė:
M pov. = 29 g/mol
Matyt, iki Avogadro dėsnio patiems ramiems protams tiek pat skirtingų dujų molekulių reikia tiek pat.
Iš to matyti kita pasekmė.
Esant pastovioms temperatūroms ir slėgiui, dujos pradeda reaguoti viena prieš vieną, taip pat į dujas panašių produktų, kurie nusėda, kaip nedideli kiekiai.
Šį dėsnį Gay-Lussac suformulavo kaip dujų tūrio dėsnį. Tokiu būdu, jei cheminė reakcija užima savo dalį arba išeina į dujas panaši kalba, tada vienodoms reakcijoms galima įdiegti mėlynos spalvos tūrius.
Obsyagi dujos, į kurias jie reaguoja, yra proporcingos šių kalbų cheminiams kiekiams:
V 1 / V 2 = n 1 / n 2 tobto. V 1 ir V 2
skaitiniu požiūriu vienodi lygių reakcijų koeficientai.1 pavyzdys. Balione telpa 0,5 kg išspausto vandens. Kokia apimtispasiskolinti tokį didelį vandens kiekį? nuplauti normalus.
Sprendimas:
1. Apskaičiuokite cheminį kiekį
vandens, už ką atkeršyti balione:N
(H 2) \u003d 500/2 \u003d 250 (mol), de M (H 2) \u003d 2 g / mol.2.Oskіlki normaliam protui 1 moliui bet kokių dujų iš viso reikia 22,4
dm 3, tadaV = Vm · n, V( H 2 ) = 22,4 * 250 = 5600 (dm 3)
Vidutinis: 5600 dm 3
Užpakalis2. Kokiame sandėlyje (proc.) aliuminio-vidutinio lydinio, nes tiriant 1 g jodo druskos rūgšties pertekliaus, buvo matyti 1,18 l. vandens?
Sprendimas:
1. Tada tik aliuminis gali reaguoti su rūgštimirašyti lygus:
2A1 + 6HC1 = 2A1C1 3 + 3H 2
2mol 3mol
2. Apskaičiuojamas cheminis kiekis vanduo:
n(H 2 ) = 1,18 / 22,4 = 0,05 (mol)
3. Pagal reakciją apskaičiuojame aliuminio masę,ką slėpti lydinyje:
3 mol 2 mol aliuminio
0,05 mol pamatyti vandenį, tarsi reaguotixmolio aliuminio
x \u003d 0,05 2/3 \u003d 0,033 (mol),
m( Al) = 0,035 27 = 0,9 (g), de M(Al) = 27 g/mol
5. Apskaičiuojamas aliuminio masės dalis metale:
w(BETl) = m ( Al ) / m (Lydinys) , w( A1) = 0,9/1 = 0,9 chi 90%.
Todi masės dalis midi lydinys 10 %
Tipas: 90% aliuminio, 10% midi
3 pavyzdys. Ryškiai išsiskirianti stiprybė: a) Pakartosiu,b) anglies dvideginio vanduo.
Sprendimas:
1. Yra žinoma, kad pažvelgus į jį matosi rūgštus:
D povit (Pro 2) =M(Pro 2)/M (pov.) = 32/29= 1,1.
2. Anglies dioksido buvimą matome pagal vandens
D H2 (CO 2) =M(Z 2 )/M(H 2) \u003d 44/2 \u003d 22.
Vidpovidas: 1,1; 22
užpakalis 4. Nustatykite dujų, kurios sudaro 0,5 molio rūgštaus ir 0,5 molio vandens, tūrįir 0,5 molio anglies dioksido.
Sprendimas:
1. Žinome cheminį dujų sumos kiekį:
n(sumiš) \u003d 0,5 + 0,5 + 0,5 \u003d 1,5 (mol).
2. Apskaičiuokite bendrą dujų kiekį:
V(sumšas) = 22,4 1,5 \u003d 33,6 (dm 3).
Plotis: 33,6 dm 3 sumos
5 pavyzdys. Apskaičiuokite anglies dvideginio tūrį, kuris išsiskiria išspjovus 11,2 m 3 metanas CH 4 .
Sprendimas:
1. Užrašykite metano degimo cheminę reakciją:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
1 apgamas1 apgamas
1 m 3 1 m 3
2. Norėdami apskaičiuoti anglies dioksido kiekį, sumuojame ir keičiame proporciją:
kai miega 1 m 3 CH 4 weide 1 m 3 2
miegant 11,2 m 3 CH 4 pločio x m 3 2
x \u003d 11,2 1/1 \u003d 11,2 (m 3)
Vidpovidas: 11,2 m 3 anglies dvideginis
6 pavyzdys. Plieninis balionas išspaustoms dujoms surinkti buvo pripildytas reta rūgščia 8 kg mase.
Koks obsyag pasiskolino dujų iš panašios į degalinę (n.o.)?
Sprendimas:
1. Apskaičiuokite reto rūgštaus cheminį kiekį:
n( O 2 ) = 8000/32 = 250 (mol).
2. Į dujas panašios rūgšties apskaičiavimas:
V( O 2 ) \u003d 22, 4 250 \u003d 5600 dm 3.
Vidutinis: 5600 dm 3
7 pavyzdys. Apskaičiuokite masę pagal 1 m tūrį 3 (n.o.), kuriame yra 78 tūriai azoto, 21 - rūgštus, 1 - argonas (kitų dujų krislas).
Sprendimas:
1. Vyhodyachi z zavdannya, obsyagi gazіv vіtrі vіdpovіdno dorovnyuyut:
V( N 2 ) \u003d 1 0,78 \u003d 0,78 m 3;
V(Pro 2) \u003d 1 0,21 \u003d 0,21 m 3
V(BETr) \u003d 1 0,01 \u003d 0,01 m 3.
2. Apskaičiuokite cheminį odos dujų kiekį:
n( N 2 ) \u003d 0,78 / 22,4 10 -3 \u003d 34,8 (mol),
n(Pro 2) \u003d 0,21 / 22,4 10 -3 \u003d 9,4 (mol),
n(BETr) \u003d 0,01 / 22,4 10 -3 \u003d 0,45 (mol).
3. Apskaičiuokite dujų masę:
m(N 2 ) = 34,8 28 = 974 (g),
m(Pro 2 ) = 9,4 32 = 30 (g),
m(BETr) = 0,45 40 = 18 (d).
4. Apskaičiuokite masę kiekvieną kartą:
m(Pakartokite) \u003d 974 + 301 + 18 = 1293 (g) arba 1,293 kg.
Svoris: 1,293 kg per dieną
8 pavyzdys. Kai podpalyuvanni į evdiometrі sumish rūgštus ir vandens, kurio tūris 0,1 m 3 bendra suma pasikeitė 0,09 m 3 .
Jakis žadavanduo ir rūgštis buvo prie išėjimo sumishi, kaip dujos, kas liko, degė (n.n.)?
Sprendimas:
1. Užrašykite vienodą reakciją:
2H 2 + Pro 2 = 2H 2 Pro
2 mol 1 mol 2 mol
2. Akivaizdu, kad į reakciją patekusios dujos.
įsipareigojo dujų maišas puolė prie gėlo vandens rahunkos, į kurią į reakciją patekusios dujos siekė 0,09 m 3 .
Nes gasi pradeda reakciją greičiu 2:1, tada nuo 0,09 m 3 dvi dalys
griūti ant vandens, o vienas - ant bučinio. Tėve, sureaguok
įėjo 0,06 m 3 vandens ir 0,03 m 3 rūgštus.
3. Apskaičiuokite dujų kiekį bendrame kiekyje.
Nes dujos, jei persipildo, dega, tai visa para yra 0,01 m 3 .
V(H 2 ) = 0,01 + 0,06 = 0,07 (m 3 ) arba 70 l,
V(Pro 2 ) = 0,1–0,07 = 0,03 (m 3 ) arba 30 l.
Siūloma: 70 litrų vandens, 30 litrų rūgštaus
9 pavyzdys. Kuo skiriasi vandens kiekis dujų mišinyje, į kurį įpilama iki 56 litrų argono ir 28 litrų azoto (n.o.)?
Sprendimas:
1. Vyhodyachi z vyznachennya vіdnoї gustina gazіv,
D H 2 = M (beprotiškas) / M(H 2 ).
2. Apskaičiuokite dujų sumos cheminį kiekį ir svorį:
n(Ar) = 5,6/22,4 = 2,5 (mol);
n(N 2 ) = 28/22,4 = 1,25 (mol);
n(summas) = 2,5 + 1,25 \u003d 3,75 (mol).
m(Ar) = 2,5 40 = 100 (g),
m(N 2 ) = 1,25 28 = 35 (g),
m(sumish) \u003d 100 + 35 \u003d 135 (g), nes
M (Ar) = 40 g/mol, M (N 2 ) = 28 g/mol.
3. Apskaičiuokite molinės masės sumą:
M(sumish) = m (beprotiškas) / n (beprotiškas) ;
M (sumišas) \u003d 135 / 3,75 \u003d 36 (g / mol)
4. Apskaičiuokite bendrą dujų kiekį vandenyje:
D H 2 = 36/2 = 18.
Data: 18 d
užpakalis 10. Ar galima prie trijų litrų banco sudeginti 3 g medinės vugilės, pripildytos rūgščiu (n.o.)?
Sprendimas:
1. Užrašykite vienodą kalnų vugilės reakciją:
Z + Pro 2 = TAIP 2
1 mol 1 mol
2. Apskaičiuokite cheminį vugilio kiekį:
n(NUO) = 3/12 = 0,25 (mol), taigi M (C) \u003d 12 g / mol.
Reakcijai reikalingas cheminis rūgštaus kiekis taip pat bus lygus 0,25 mol
3. Apskaičiuokite rūgščio tūrį, reikalingą 3 g degtinės atskilimui:
V(O 2 ) = 0,25 22.4 = 5,6 (l).
4. Oskіlki dujos pasiskolina indo tūrį, tame pačiame vyne žinoma, є 3 litrai rūgšties. Otzhe, nesiūkite kilkos už spalyuvannya 3 g vugillya.
Patarimas: nesiūkite
užpakalis 11. Ar kiek kartų padidinti retų vandenų tūrį ateityje transformuojant į porą n.s.?
Dėl cheminių reakcijų aA + bB = cC + dD
pabusti
de nA ir nB – sureaguotų laisvų kalbų skaičius, ps ir nD – ištirpusių produktų skaičius, a, b, c ir d – stechiometriniai koeficientai.
Iš kalbų skaičiaus lengva pereiti prie mišių:
Kalboms, panašioms į dujas, dažniau nustatoma chi, kad reikštų jų įsipareigojimus. Jei reagentas ir produktas D yra dujos, atlikite perėjimą nuo šių kalbų kaulų skaičiaus prie jų:
![]()
Vіdomih (per mintis) kiekio, masi arba įpareigoja (už dujas) vieną iš kalbų, kurios dalyvauja reakcijoje, galima išvesti visų dydžių vertes kitoms kalboms.
Esant skirtingoms A ir B dujų sumoms, iš kurių viena dalyvauja reakcijoje, galite žinoti sp_v_dnoshnenja їkh obsyagіv VA: VB, o tam tikram sp_vv_dnoshnі - їkh obsyag sumіshi (arba navpaki).
Užpakalis rozvyazannya užduotis
Aukštoje temperatūroje magnis reaguoja su azotu, pažiūrėkime į argono sumą, kurio bendras tūris 5,6 l (n.o.) ir įpilama 15 g nitrido. Apskaičiuokite dujų tūrį V(N2): V(Ar) prie išeinamosios sumos.


Užduotis už savarankiškas sprendimas A dalis
1. 6 l azoto oksido (II) sureagavo su 5 l rūgštaus
2. Uždarame inde sudegė 24 g grafito 67,2 l (n.a.) rūgščių ir pašalintas rūgščio tūris: produktas lygus.
3. Per ozonatorių praleido 7,5 mol rūgščių, kurios dažnai virsdavo ozonu. Likę po dažymo „pasūdymui“ (normaliems protams) 0,5 mol kraujo vandens (grįžtant į SO2); vėliau O3: O2 tūris prie išėjimo iš ozonizatoriaus tapo
4. Kalio bromidas, kurio masė 142,8 g, šiek tiek sureagavęs su chloru, imsime jį tokiu pačiu kiekiu pakartojimų tūrio santykiu 1 (chloras): 2 (kartokite). Galny obsyag (litrais)
5. Norint visiškai sudeginti 17,92 l (n.o.) sumišo CH4 + H2, reikėjo 1 molio rūgštaus. Dienos pabaigoje bendras CH4:H2 kiekis yra ryškesnis:
6. Dujos A, skrudindami ant katalizatoriaus 0,04 mol KClO3, išėmėme (esant na) indą su dujomis B, kas buvo matyti ištyrus 6 g kalcio su vandeniu ir atėmėme tūrių A sumą: B , lygus
7. Išspjovus nitrobenzeną į perteklinį rūgštingumą produktų (azoto, anglies dioksido, vandens) sumos, kurioje pasišalina 4 litrai (na) azoto, o N2:O2 tūris didesnis kaip 4:1. litrais. , n. u.) rūgstant
8. Atliktas 1 mol amonio chlorido terminis skaidymas plieniniame balione, kuriame taip pat buvo 11,2 l (n.a.) amoniako. Kіntseve ob'єmne vіdnoshennia NH3: НCl dorovnyuє
9. Sumish rūgštus ir chloras, kurio tūris 9: 1 vikoristanas, kad pamatytumėte 0,5 mol paprastos kalbos su KI diapazonu
10. Kissenas buvo perleistas per ozonatorių, kai ant katalizatoriaus buvo skrudinta 1 mol KClO3, kai 5% rūgštus buvo paskrudinta, rūgštis pavirto ozonu ir išeinant iš ozonatoriaus sumažėjo O2: O3 tūris.
Plonai lydalo metalo-polimero sistemų liejimo iš dujinės fazės fizikiniai-cheminiai dėsningumai
Plonai lydytos metalo-polimerinės medžiagos (metalo polimerai, metalinės plokštės su plonomis polimerinėmis dangomis, turtingos rutulinės sistemos ir kt.), kurios formuojamos vakuumine technologija.
Ge epitaksinis augimas ant Si(100) paviršių
Iš plonų dėmių fizikos galima pasiekti tolesnio mikroelektronikos, optikos ir kitų naujų technologijų pritaikymų plėtros perspektyvas. Sėkmės mikrogaminant elektronines...
Komponentai, kurie gali būti galingi ir sumažinti polimerinių medžiagų degumą
Po kurio laiko šalies ekonomika bus išgelbėta nuo šimtų milijonų rublių. Deginant polimerines medžiagas matosi didelis skaičius toksiškos dujos, kurios kenkia žmonėms ir...
Pamokos tikslai:
Peržiūrėkite vietoj dokumento
„9 chemijos klasė Mėlynųjų dujų tūriai cheminėse reakcijose. Suminio dujų suvartojimo apskaičiavimas cheminėms lygybėms.
Chemijos pamoka tema „Mėlynųjų dujų tūris cheminėse reakcijose. Bendro dujų suvartojimo apskaičiavimas cheminėms lygybėms
3 pamoka apie kritinio mąstymo techniką
Pamokos tikslai: iš organinės kalbos cheminių reakcijų užpakalio formuoti žinias apie dujinės kalbos vandens tūrių dėsnį; sudaryti o'mnih spіvvіdnoshen įstatymą rozrahunkіv іz khіmіchnyh rivnyan. Dodoskonaljuvati vminnya uchnіv virіshuvati rozrakhunkovі zavdannya shdo rіvnyan khіmіchnih reaktsіy. Plėtoti vmіnnya uchnіv sandėlį khіmіchі zavdannya. Ugdykite kritinį mąstymą. Suformuokite teigiamą nustatymą, kol objektas bus baigtas, nustatymų apibendrinimą prieš užduoties pabaigą.
Nuosavybė: užduočių kortelės.
Paslėpta pamoka.
aš.Apšilimas(Mokiniai pasimeta savo mintyse)
A. Fransas „Jei žmogus mąstys, jis nebus sumnivas, bet nebus sužavėtas, jei...“
Kaip baigei šią frazę?
Išmokite praktikuoti grupėse. Užsirašykite siūlomus variantus. Pasirinkite tі, yakі ant їhnyu dumku tinka daugiau.
Višnovok: „Jei žmogus mąsto, jis nesusipainios, bet nebus dainuojamas, jei taip“.
Esu dešinėje, nes esu užsiėmęs pamokoje, kad smogčiau tau ir parodyčiau tavo veržlumą dabartyje.
II. Motyvacija mokymosi veiklai.
Apstulbino tie, kad pamokos vadovas.
S. Atnaujinimo žingsniai
Už diagramos V_den atspėkite alkenіv ir alkіnіv cheminę galią.
Kodėl tau rūpi krūminis susitraukimas kokios dujos n.s.
Pasiūlymas: 22,4 l/mol
Kaip suformuluotas Avogadro dėsnis?
Pasiūlymas: Už tuos pačius skirtingų dujų įsipareigojimus, už tuos pačius protus (t, p), atkeršijama tiek pat molekulių.
Visnovok:Į dujas panašių reagentų ir reakcijos produktų kiekiai koordinuojami taip, kad jų koeficientai reakcijoje lygūs. Tsya zakonіrnіst vikoristovuєtsya už khіmіchnyh rozrahunkіv.
Kūrybinė užduotis:(Suteikia jums galimybę persvarstyti, turint stiprių mokslininkų žinių šia tema)
Trijuose sunumeruotuose mėgintuvėliuose, užkimštuose kamščiais, є: metanas, etilenas, acetilenas. Kaip atpažinti, kur žinoti dujas?
IV. Pranešimo žingsniai(Medžiagos pažinimas, pagrįstas problemomis, tiesos paieška).
Paskaita buvo sustiprinta („Karuselė“: pagrindinis supratimas, kaip vestuvių diena duodama pradžioje; po pabaigos studentai susivienija į lažybas, laimi panašias užduotis; sumuoja tą pačią užduotį, pvz., vestuvių diena ir pan. .)
Chloro tūris (n.o.), kuris reaguos su 7 litrais propeno:
a) 14 l; b) 10 l; c) 7 l; d) 22,4 litro.
3. Apskaičiuokite bendrą pinigų sumą, kurios jums reikia sumišių sumušimui,
prideda iki 5 l etileno ir 7 l acetileno (n.o.).
Nurodykite, kokio tūrio vandens reikia pilnai 7 litrų etileno hidrolizei, kol reakcija bus lygi:
Z 2 H 4 + H 2 \u003d Z 2 H 6 a) 7 l; b) 6 l; c) 14 l; d) 3,5 litro.
Dirba poros. Besimokantieji, susivieniję, sudaro panašius nurodymus, kaip virishu sudidnya pora:
Pilnam laistymui reikalingas vandens tūris – 15 litrų butino, daugiau: a) 15 litrų; b) 30 l; c) 7,5 l; d) 3,5 litro.
Į 5 l acetileno pridedamas bet koks tūris chloro, priklausomai nuo reakcijos C 2 H 2 + 2Cl 2 \u003d C 2 H 2 Cl 2
a) 5 l; b) 10 l; c) 2,5 l; d) 22,4 litro.
3. Apskaičiuokite visas išlaidas, nes reikia išleisti taupant
10 m3 acetileno (N.O.).
V. Atspindys
Vikonannya užduotis iš kortelės.
Apskaičiuokite bendrą vandens kiekį, poreikį pakartotinai laistyti X kalbą.
(Išmoks savarankiškai pildyti lentelę, atlikę darbą atsakys į klausimus).
| Obsyag kalba X, l | Kalbos formulė X | Rivnyannya gidrovannya | vanduo, l |
|
VІ . Visnovki iš pamokos
Suformuluojama būsimos pamokos užduotis.
VІ aš. Maišeliai pamokai
VIII. Namų darbai
Propratsiuvati 23 pastraipa, vikonati dešinėje 206, 207 šone.