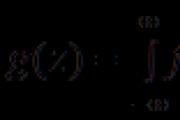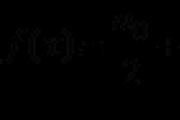Promjena kemijskih elemenata. "Vzaêmodiya atomív elementi-nemetalni mízh sami" (8 razred)
Svrha lekcije:
- Publikacije stavova o različitim vrstama kemije.
- Ponovite sheme postavljanja govora s drugom vrstom zvuka. Nastavite obrazac za zapisivanje na stražnjice.
- Porívnyati različiti tipi prsten.
Zavdanija lekcija:
- Zakrípiti svjedok elektronegativnosti kemijski elementi, vrste kovalentne veze: polarna i nepolarna;
- Ispraviti pametne elektronske formule, strukturne formule, objasniti mehanizam uspostavljanja kovalentnih veza; vikoristovuvati nabutí znanje i vínnya iz praktične aktivnosti;
- Uzmite razvoj zajedničkih umova;
- Razvoj logičkih poruka.
Osnovni pojmovi:
- Metal - puno kemijskih elemenata, atomi od kojih je lako prikazati vlastita imena elektronike, preispitujući pozitivne.
- Nemetali - cijena kemijskih elemenata čiji atomi posljednji put prihvaćaju elektroniku, ponovno se transformirajući u negativne
- Oni - Punjenje čestica, na kojima se atom pretvara u poruku, odnosno prihvaćanje elektronike.
- Elektronegativnost - troškovna učinkovitost atom kemijski element za privlačenje elektronike atoma.
- Veseli poziv
- cijeli način interakcije atoma, što dovodi do odobravanja molekula.
SKRIVENA LEKCIJA
Interakcija atoma elemenata-nemetala sa samim sobom
Za klip, hajde da pogodimo, kao obična tablica elemenata, a vidljiva ni u metalu, ne metalu, metalu. Pomozite nam sa slikom 1.
Mali. 1. Periodni sustav elemenata
Poznata lopta atoma nemetala smještena je od 4 do 8 elektrona.
Vinatok: H (1e); Chi ne (2e); (3e)
Polumjer atoma nemetala manji je od polumjera atoma metala.
Kemijski elementi su nemetalni, djeluju iz periodnog sustava uha glava skupina, popravljeno iz treće skupine i prvi put, tobto. u desnom gornjem dijelu periodnog sustava. Malunok 2.
Mali. 2. Rotacija nemetala u periodičnim sustavima
Kemija snage nemetala
Kemijski nemetalni elementi mogu se pojaviti kao oksidi, kao i osjetna snaga, ispala iz kemijske rekonstrukcije, u kojoj sudjeluje smrad.
Atomi najelektronegativnijeg elementa - fluora - ne nastaju iz struje, nije važno je li to oksidacijska snaga, to su neki elementi koji mogu doći i otići, ako će biti moćniji od svijeta. Većina jakih oksidacijskih sredstava - fluor, kiselina i klor, važni su za vodu, bir, ugljik, silicij, fosfor, mish'yak i telur. Industrijska oksidativna snaga može sadržavati dušik, sirku, jod.
Angažman jednostavnim riječima
1. Odnos s metalima:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
u cich vipadkah nemetali vyavlyayut oksidirane snage, smrad uzeti elektroniku, potvrđujući negativno nabijene čestice.
Na videu možemo pogledati interakciju između natrija i klora
2. Interakcija s drugim nemetalima:
u sprezi s vodom veliki broj nemetala ima oksidativnu moć, te je u stanju tvoriti vodene spoluke - kovalentne hidride:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
u sprezi s kiselim, svi nemetali, uključujući fluor, pojavljuju se u istoj snazi:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
u slučaju interakcije s fluorom, fluor se oksidira, a kissen je dominantan:
2F2 + O2 = 2OF2;
sami nemetali vzamod_yut mízh, više elektronegativni metal je uloga oksidacijskog sredstva, manje elektronegativni - uloga olova:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.
Na malima pogledajte kovalentne polarne i nepolarne veze. Usmjerite kraj elemenata, što će djeci pomoći da ih vide.
Mali. 3.
Mali. 4. Kovalentna nepolarna veza
Na videu 2 možete proviriti i čuti kovalentni nepolarni prsten
Predmeti> Himíâ> Himíâ 8 razredZadovoljstvo
Pravila za obnovu koristuvachiv na stranici "ZNAK YAKOSTI":
Za podizanje obnove koristuvachív s njima, pokupite: 111111, 123456, ytsukenb, lox í.t.p;
Za ponovni ulazak na stranicu (postavite dvostruki račun);
Stupite u kontakt sa strancima;
Stupite u kontakt s tuđim e-mail adresama;
Pravila ponašanja na stranici, forumu i u komentarima:
1.2. Objava u upitniku posebne počasti za prvi koristuvachiv.
1.3. Biti poput destruktivnih radnji koje se daju na resurs (destruktivne skripte, lozinke, oštećeni sustavi i loše).
1.4. Vikoristannya yak nikname nepristojnih riječi i viraziv; vislov_v, jer krše zakone Ruska Federacija, etičke i moralne norme; U slučaju fraza sličnih bilo kojem administratoru ili moderatoru.
4. Uništenje 2. kategorije: Kazniti se cijelom ogradom na smjeru bilo kakvog pojavljivanja na linijama do 7 dB. 4.1.Smanjenje informacija, kao i na temelju Kaznenog zakona Ruske Federacije, Upravnog zakona Ruske Federacije i nadzora Ustava Ruske Federacije.
4.2. Propaganda u bilo kojem obliku ekstremizma, nasilja, zhorstokosti, fašizma, nacizma, terorizma, rasizma; razvoj međunarodnog, međunarodnog i društvenog obrazovanja.
4.3. Netočno dogovaranje robota i slika na adresi autora tekstova i bilješki objavljenih na marginama "YAKOST ZNAK-a".
4.4. Prenesite na adresu sudionika foruma.
4.5. Distribucija lažnih informacija, zakovice i druge vrste zgrada, kako hakirati čast i posjetiti i ljude i ljude.
4.6. Pornografija u avatarima, povremeno i citatima, kao i na pornografskim slikama i resursima.
4.7. Pogledajte raspravu za administratora i moderatore.
4.8. Javna rasprava i ocjena pravednih pravila u bilo kojem obliku.
5.1. Mat i vulgarnost.
5.2. Provokacije (posebne vipade, posebna diskreditacija, formiranje negativne emocionalne reakcije) i broj sudionika pregovaran (sustavno pobjedničke provokacije sto posto sudionika).
5.3. Provokuvannya koristuvachív na sukob jedan po jedan.
5.4. Grubost i bezobrazluk odnosa prema sp_vrozmovnik_v.
5.5. Idite na pojedince i z'yasuvannya posebnih poruka na forumu.
5.6. Poplava (identična ili nedostatak promjene)
5.7. Nema greške u pisanju pseudonima i imena corystuvachi u obrazovanom obliku.
5.8. Smanjenje citiranih informacija o tome kako ga pjevam zmist.
5.9. Izdavanje posebnog letaka bez jasno izraženog zgoda sponzora.
5.11. Destruktivno trolanje - cilj je ponovno provesti pregovore za okršaj.
6.1. Precitiranje (previše citata) povremeno.
6.2. Vikoristannya na font crvene boje, namijenjen za ispravljanje i poštivanje moderatora.
6.3. Nastavak rasprave od strane moderatora i administratora.
6.4. To je dio onih koji ne nose osjećaj svrhe, ili provokativnu za zmiju.
6.5. Naslov su napravili oni, ako su moj zemaljski... Vinyatok je plašljiv za naslove post-tema i onih koje su najavili moderatori.
6.6. Pisanje potpisa većim fontom, nižim od posta, i registriranje potpisa u više od jedne palete boja.
7. Sankcije, koje će biti fiksirane prije pravila Foruma
7.1. Timchasova abo post_yna zaborona pristup Forumu.
7.4. Vidalennya obl_kovogo zapis.
7.5. Blokuvannya ÍR.
8. Bilješke
8.1. Pohranjivanje sankcija od strane moderatora i administracije može se izvršiti bez objašnjenja.
8.2. Pravila mogu uključivati izmjene, o čemu će svi članovi stranice biti obaviješteni.
8.3. Koristuvacham zaboronyaêtsya vicoristovuvati klonove u razdoblju od sat vremena, ako je glavni nick blokiran. Klon je blokiran bez niza, a glavni nadimak je uklonjen iz dodatkovog dob-a.
8.4 Kad god se želite osvetiti opscenom jeziku, može ga urediti moderator ili administrator.
9. Administrativna uprava stranice "ZNAK YAKOSTI" zadržala je za sebe pravo uvida u bilo kojoj prigodi i bez objašnjenja. Administrator stranice zadržao je za sebe pravo uređivanja računa profila službenika, budući da će ih podaci u njima lišiti pravila foruma. Podaci će biti prošireni na moderatore i administratore. Administrator ima pravo promijeniti ili dodati dodatna pravila po potrebi. Nepoznavanje pravila nije čujno zbog propusta. Administrator stranice ne mora prepisivati sve podatke da bi ih objavio. Kad god to vidite, ne možete zamisliti autorovu misao da ne možete biti viktorijanac za procjenu misli svih sudionika foruma. Promjene web stranice i moderatora predstavljaju posebne ideje i uredništvo web stranice ih ne smije uzeti u obzir.
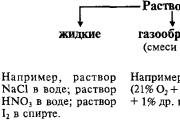
I. Klasifikacija kemijskih spojeva
1. Iza mehanizma stvaranja bezobraznog zvuka
a) obminniy Ako je atom uvrijeđen, onda pozovite, izvršite neupareni električni priključak za nju.
Na primjer, odobrenje molekula s vodom H2 i klorom Cl2:
b) donor-akceptor Ako je jedan od atoma potreban za vezu, spreman sam par elektrona (donator), a drugi atom - isprazniti virtualnu orbitalu.
Na primjer, odobravanje ionskog amonijaka (NH4) + (dio je naplaćen):
2. Za metodu recirkulacije elektroničkih orbita
a) σ - veza (sigma) ako maksimum uvijanja leži na liniji, koja je na dnu središta atoma.
Na primjer,
H2 σ (s-s)
Cl2 σ (p-p)
HCl σ (s-p)
b) π - zvuk (pí) ako maksimum prekomjerne struje ne leži na liniji, već od donjeg središta atoma.
3. Za način dostizanja dovršene elektronske ljuske
Atom kože je pragmatičan da dovrši vlastitu elektroničku kožu, a način za postizanje takvog oblika može biti mali.
|
Znakovi porvnyannya |
Kovalentan |
Ionna |
Metaleva |
|
|
nepolarni |
polarni |
|||
|
Yak dosegnuti završenu elektroničku školjku? |
Uzagalnennya elektronív |
Uzagalnennya elektronív |
On-the-fly prijenos elektronív, odobrenje ionív (čestica punjenja). |
Uzagalnennya elektronív usíma atoma u Kristu. ´ratah |
|
Yaki uzeti sudbinu atoma? |
nime - nime EO = EO |
1) Nemeth-Nemeth1 2) Met-nimet EO< ЭО |
met + [Nimet] - EO<< ЭО |
Na sveučilištima postoje kation i atom metala. Veza je ovdje kako bi se slobodno kretala u prostoru elektronike između čvorišta. |
|
∆c = EO1 - EO2 |
< 1,7 |
> 1,7 |
||
|
Staviti na |
jednostavne riječi – nemetali. |
kiseline, oksidi |
soli, livade, oksidi metala |
jednostavne riječi – bacio. Veze u metalima i legurama, koje su vidljivo jake u elektronima i metalnim ionima u metalnim kristalima. |
II. Bit kovalentne veze
Kovalentna veza - ne postoje veze, ali nema problema između atoma za uspostavljanje udaljenih elektroničkih parova (npr. H2, HCl, H2O, O2).
Iza koraka zamjene udaljenih elektroničkih parova jednim od atoma povezanih s njima, kovalentna veza može biti polarniі nepolarni.
ÍÍÍ. Kovalentna nepolarna kemijska veza
Kovalentna nepolarna veza (CNS) - čine atome jednog te istog kemijskog elementa – nemetala(Na primjer, H2, O2, O3).
Mehanizam komunikacije
Atom kože i nemetal prikazan je u stražnjoj prostoriji elektroničkog uparivanja. Elektronske oklade su postavljene. Elektronički par sličan je atomima.
Mehanizam otopine molekule klora je jasan: Cl2- KNS.
Elektronička shema potvrde molekule Cl2:
Strukturna formula molekule Cl2:
Cl - Cl, σ (p - p) - jedna veza
Demonstracija odobrenja molekule
Mehanizam postavljanja molekule je jasan: O2 - kns.
Elektronička shema odobrenja molekule O2:
Strukturna formula molekule O2:
O = O
π
Molekula ima višestruku podvezu:
jedan σ (p - p)
onaj π (p - p)
Demonstracija odobrenja molekula kiselosti i dušika
IV. Zavdannya za zakr_plennya
Zavdannya broj 1. Pogledajte kemijske zvukove u molekulama uvredljivih riječi:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Zavdannya broj 2. Napišite mehanizam odobravanja molekula H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2. U jednoj kovalentnoj vezi postoji vrsta recirkulacije elektroničkih hmara (π ili σ), kao i mehanizam odobravanja (razmjena ili donor-akceptor)
Razmotrili smo i kako spojiti atome metalnih elemenata s atomima nemetalnih elemenata: vide se vlastita imena elektronike i iznova stvaraju kada su u pitanju pozitivna, a prihvaćaju negativna Oni će biti privučeni jedan na jedan, zadovoljni jednim spoluky.
A kako može postojati veza između atoma nemetalnih elemenata, kako da se spustim u trend prije dolaska električnih uređaja? Jasno je da postoji veza između atoma istog kemijskog elementa, na primjer, u blizini rijeka, koji mogu sadržavati dvoatomske molekule: dušik N 2, vodu H 2, klor C1 2.
Poštovanje, za prikaz skladišta cich riječi za dodatne kemijske znakove, također i vikorističke indekse.
Dva identična atoma nemetalnog elementa mogu se ujediniti u molekulu na samo jedan način: korištenjem vlastitih imena elektrona, kako bi zvučali kao tajna za oba atoma.
Jasno, na primjer, odobrenje molekule fluora F2.
Atomi fluora - element glavne grupe VII (skupina VIIA) Periodični sustav kemijskih elemenata D. I. Mendeleva - Svibanj na najnovijoj energetskoj razini elektrona, a atom kože se ne pojavljuje sve do svog završetka, oduzimajući jedan od elektrona. Imena elektrona atoma fluora mogu postaviti tri elektronička oklada i jedan nespareni elektron:
Čim se dva atoma približe i u njihovoj koži bude jedan jedini nespareni elektron, tada se elektroni "povezuju" i postaju udaljeni za oba atoma, pri čemu se završeci nazivaju osmoelektronska jaruga.
Odobrenje molekule fluora prikazano je na dijagramu:

Yaksho označi elektronički par crtežom, zapiši strukturnu formulu, na primjer, strukturnu formulu molekule fluora
Slično kao kod molekula fluora, uspostavlja se dvoatomska molekula vode N 2:

Slid vrahuvati, koji dovršava za atom bit će dvoelektronski r_ven, koji se dodaje dovršenom r_venu atoma s helijem.
Strukturna formula molekule je vodna
![]()
Pojasnimo našu izjavu o kovalentnoj vezi na stražnjoj strani odobrenja molekule, vikoristovuyuchi razumijevanje elektroničkog klauna (Div. § 9). Kada su dva atoma blizu jedan drugome, kada je jedan s-elektronički mrak sferičan, vidjet ćete preusmjeravanje elektroničke tame. Uz širok raspon uvjeta, područje (miševi), priroda negativnog naboja je najvažniji, a još negativniji naboj. Pozitivno nabijena jezgra se privlači (istodobno tijekom fizike) i molekula se uspostavlja. U takvom rangu, veseli zvuk rezultat je niza električnih sila. To se jasno vidi u shemi viglyad:

Slide znači, da na temelju znanja o kovalentnoj vezi, kako i kada se pronađe ionska veza, leži u načinu naboja protiv naboja.
Na kraju se uočava Mirkuvan algoritam, potrebno je zapisati shemu komunikacije kovalentne veze, na primjer, za molekulu dušika N 2.
1. Dušik je meta glavne skupine V skupine (VA grupa). Yog atom može imati pet elektrona na najnovijoj razini. Međutim, postoji niz nesparenih elektrona koji su brzi koristeći formulu:
8 - N = broj nesparenih elektrona,
de N je broj grupe kemijskog elementa.
Atomi dušika već mogu proizvesti (8-5 = 3) tri nesparene elektronike.
2. Iz naznačene vrste elektrona moguće je zapisati znakove kemijskih elemenata, tako da nespareni elek-
![]()
3. Elektronska strukturna formula molekule koja se može pisati, a koja je navedena:
Ako su atomi povezani jednim jedinim elektronskim parom, onda se takva kovalentna veza naziva jednostruka, ako je dva - podsloj, tri - nazivamo je.
S više elektronskih parova od atoma do molekula, tada je manje smrada vezano jedan na jedan, a manje je jezgra atoma, kako je zovu drugi prsten. U molekulama fluora veza je jednostruka, a veza između jezgri atoma postaje 0,14 nanometara (1 nm = 10 -9 m, odnosno 0,000000001 m). U molekulama dušika, izgledi i krajevi postaju 0,11 nm. Za razbijanje molekule dušika na atomu potrebno je vitrirati otprilike sedam puta. više energije niz za razbijanje pojedinačnih karika u molekulama fluora.
Ključne riječi i riječi
- Atomska, ili kovalentna, kemijska veza.
- Pojedinačne, podređene i zahtjevne kovalentne kemijske veze.
- Dovžinov prsten.
- Elektroničke i strukturne formule.
Robot s računalom
- Budite dorasli elektroničkim programima. Vivchit materijal za lekciju i vikonayte proponed zavdannya.
- Upoznajte na internetu elektroničke adrese, koje mogu biti dodatne lutke, koje otvaraju promjenu ključnih riječi i riječi odlomka. Pomozite čitatelju u pripremi nove lekcije – da nauči više o ključnim riječima i riječima uvredljivog odlomka.
Napajanje i napajanje
- Napori glavne grupe VII grupe (VIIA grupa) Periodični sustav D. I. Mendeleva (pidgrupy fluor) jednostavne su riječi, koje se sastoje od dvoatomskih molekula. Zapišite elektronički dijagram kako biste pregledali strukturnu formulu takvih molekula, opaki kemijski znak za sve skupine hrane G (halogen).
- Zapišite dijagrame uspostavljanja kemijskih veza govora, čije je skladište predstavljeno formulama KS1 i C1 2.
- Koliko nesparenih elektrona možete zamisliti o atomima? Koja će veza biti u molekulama S2? Zapišite shemu za uspostavljanje kemijske veze u molekulama S2.
- Kako biste poboljšali kvalitetu kemikalije, upotrijebite formule S 2, Cl 2, N 2 i ovjerite ispravnost svoje odluke. Yak zmínyuvatimetsya dovzhina zvuk u molekulama presavijeni vam red?
- Rast govora na dvije skupine prema vrsti kemijske veze: N2, Li2O, KC1, O2, CaF2, H2.
Tema: Kovalentna nepolarna veza
Zavdannya:
Formulirajte tvrdnju o kovalentnoj vezi, krema je kovalentna nepolarna veza;
Pokazati mehanizam uspostavljanja kovalentne nepolarne veze;
Prodvzhiti razvoj min, analizirati, robiti visnovka;
Vihovuvati kulturu splilkuvannya.
Motivacija i svrha izvještavanja:
Koja je točka dušika i vode u dvoatomskim molekulama? U procesu razvoja i dobrog zdravlja svrha izlaganja temelji se na temi sata.
Vivchennya novi materijal:
Pogledajmo kako se možemo pretvarati da imamo bezobrazan prsten molekulaCl 2.
Atom klora je unutraVIIAGrupe periodičnih sustava, iz istih, u mnogo elektrona na najnovijoj energetskoj razini, a za njegovo dovršavanje ne treba vam još jedna elektronika. Određeni broj elektrona najnovije razine daje okladu, a jedan se rasparuje. Dva atoma klora, poput jednog nesparenog elektrona, približavaju se jedan drugome, elektroni se "ujedinjuju" i rastapaju oba atoma, a razdire svoje krajeve - osam elektronskih. Mogu nabaviti par elektron_v samo riže.
Odnosno, kovalentna veza, ili atomsko - kemijska veza, koja je rezultat uspostavljanja elektroničkih parova.
Cijela je kemijska veza uspostavljena između atoma jednog te istog nemetala, sa svim elektronskim okladama koje su napravljene, da se na oba atoma polažu u jednostavnom svijetu, i na njima neće biti viška, i bit će nema negativnog naboja nepolarni.
Slično, molekula H 2. Međutim, atom je unutraIAskupinu, za to je kožni atom manji od jednog elektronika i do kraja kon energična rívnya ne vistachaê sve jedan elektronski (valjda, za atome u vodi i helij, mi ćemo ga dovršiti, kao na nova 2 elektrona). Atom kože može biti spojen na jedan po jedan elektron, a jedan elektron nije uparen, a elektronički par se može povezati, kao što je moguće označiti slikom.
Osim toga, kada su dva atoma blizu jedan drugom, mršavi su u jednom s-elektronskom mraku, sfernom obliku, pojavit će se križ elektroničkog mraka. Pritom se uspostavlja područje, kapacitet negativnog naboja je velik, pozitivno nabijena jezgra se k njemu privlači i molekula se uspostavlja.

Pogledajmo mehanizam postavljanja veće sklopive molekule 2 .
Kisen je unutraPREKOgrupe, iz iste, imamo 6 elektron_v na najnovijoj razini. Pa ipak, ako je broj nesparenih elektrona značajan, možete koristiti formulu 8 -N, deN- Grupni broj. U dermalnom atomu bit će 2 nesparena elektrona, koji će sudjelovati u uspostavljenom kemijskom prstenu. Dva nesparena elektrona mogu se natjecati s dva nesparena elektrona istog atoma i napraviti dvije elektronske opklade, pa je pametno moguće zamisliti dvije smokve u gledatelju.
Oscilacije karika u molekuli kiseline pohranjene su u dva elektronska para, a zovu je podzemna, bit će moćnija, nije pojedinačna, kao što je molekula voda. Samo potreba za inteligencijom, izvan male veze između atoma u molekulama, manje je vjerojatno da ćemo biti među jezgrama atoma. Qia se počela nazivati pre-genie sound. Zadnji prsten je kraći za metro, ale više motsnish. Na primjer, u molekuli dušika postoji i treća karika, ali da bi se molekula razbila na dva atoma, potrebno je vitrirati u višestruko više energije, a ne prekinuti jednu kariku u molekuli klora.
Objavljivanje i sistematizacija znanja:
Koja se vrsta kemije naziva kovalentna?
Postoji li kovalentna nepolarna veza između atoma određenih elemenata?
Koja je bit uspostavljanja kovalentne veze?
Želite li jedan prsten proizaći iz podbaze i otpadnog?
Pokazat ću ti zvuk i tko mora ležati?
Potvrda i kontrola znanja:
Stavite sheme za odobravanje molekula govora: a) brom; b) fluor; c) dušik.
Promijenite red kože:
a) CO 2 , NH 3 , P 4 , P 2 O 5 ;
b) Cl 2 , S N 2 , CO 2 .
Pogled:
a)P 4 ; b)Cl 2 , S, N 2 ... Lanac s kovalentnom nepolarnom vezom.
Vibracijski govor s kovalentnom nepolarnom vezom:
P 4 , H 2 S, NH 3 , P 2 O 3 , S N 2 , O 2 , H 2 O, HCl, H 2 .
Pogled: govori s kovalentnim nepolarnim prstenom fiksirani su s istim atomima nemetala, pa će postojatiP 4 , S, N 2 , O 2 , H 2 .
Refleksija i pídbittya pídsumkív:
Yak vi vvazhaête, yak naučio materijal za lekciju? dobro; b) dobro; c) u dobrom stanju; d) nije stečeno.
Kako možete odmah dobiti napajanje, kako ste ga stavili na klip za lekciju?
Domaća zadaća:
jarazina: §11, pr. trinaest;
IIr_ven: tezh + vježba. 4, 5.