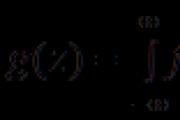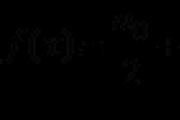Chemijos elementų keitimas. "Vzamodiya atomіv elementai-nemetalіv mіzh patys" (8 klasė)
Pamokos tikslas:
- Požiūrių apie įvairias chemijos rūšis publikacijos.
- Pakartokite kalbos nustatymo schemas su kitokio tipo garsu. Tęskite formą ir užsirašykite ant užpakalių.
- Porіvnyati різні tipižiedas.
Zavdaniya pamoka:
- Zakrіpiti šmaikštūs elektronegativnosti cheminiai elementai, kovalentinio ryšio tipai: polinis ir nepolinis;
- Pataisyti sumanias elektronines formules, struktūrines formules, paaiškinti kovalentinių ryšių kūrimo mechanizmą; vikoristovuvati nabutі žinių ir vіnnya iš praktinės veiklos;
- Ugdykite bendruomeninį protą;
- Loginių pranešimų kūrimas.
Pagrindinės sąlygos:
- Metalas - daug chemijos elementų, kurių atomus lengva atvaizduoti savo elektronikos pavadinimus, pergalvojant apie teigiamus.
- Nemetalai - cheminių elementų kaina, kurių atomai paskutinį kartą priima elektroniką, vėl transformuojasi ant neigiamų.
- Jie - Įkraunamos dalelės, ant kurių atomas paverčiamas pranešimu, arba priimti elektroniką.
- Elektronegatyvumas - sąnaudų efektyvumas atomas cheminis elementas, pritraukiantis atomo elektroniką.
- Linksmas skambutis
- visas atomų sąveikos būdas, vedantis į molekulių patvirtinimą.
PAslėpė PAMOKA
Elementų-nemetalų atomų sąveika su pačiu savimi
Dėl burbuolės, spėkime, kaip įprastą elementų lentelę ir matome ne metalas, nemetalas, metalas. Padėkite mums su 1 pav.
Mažas. 1. Periodinė elementų lentelė
Garsusis nemetalų atomų rutulys yra nuo 4 iki 8 elektronų.
Vinatok: H (1e); Chi not (2e); (3e)
Nemetalų atomų spindulys yra mažesnis nei metalų atomų spindulys.
Cheminiai elementai yra nemetaliniai, jie veikia iš periodinės galvos grupių ausies sistemos, remontuojami iš trečios grupės ir pirmą kartą, tobto. dešinėje viršutinėje periodinės sistemos dalyje. Malūnokas 2.
Mažas. 2. Nemetalų sukimasis periodinėse sistemose
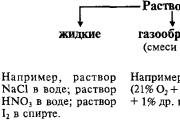
Nemetalų galios chemija
Chemiškai nemetaliniai elementai gali pasirodyti kaip oksidai, taip pat juntama galia, nukritusi iš chemiškai pervaidinimo, kuriame dalyvauja smarvė.
Elektroneigiamiausio elemento - fluoro - atomai atsiranda ne iš elektros, nesvarbu, ar tai oksidacinė galia, tai kai kurie elementai gali ateiti ir išeiti, jei jis bus galingesnis už pasaulį. Dauguma stiprių oksidatorių – fluoras, rūgštis ir chloras, yra svarbūs vandeniui, birui, anglimi, siliciui, fosforui, mišjakui ir telūrui. Pramoninės oksidacinės galios sudėtyje gali būti azoto, sirkos, jodo.
Susižavėjimas paprastais žodžiais
1. Ryšys su metalais:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
Cich vipadkah nemetaluose vyavlyayut oksiduojasi galia, smarvė imti elektroniką, patvirtindama neigiamai įkrautas daleles.
Vaizdo įraše galime pažvelgti į natrio ir chloro sąveiką
2. Sąveika su kitais nemetalais:
kartu su vandeniu daug nemetalų turi oksidacinę galią ir gali sudaryti vandens spolukus - kovalentinius hidridus:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
kartu su rūgštu, visi nemetalai, įskaitant fluorą, yra vienodos galios:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
Sąveikos su fluoru atveju fluoras oksiduojasi, o bučinys vyrauja:
2F2 + O2 = 2OF2;
nemetalai vzamod_yut mіzh patys, daugiau elektroneigiamo metalo yra oksidatoriaus vaidmuo, mažiau elektroneigiamo - švino vaidmuo:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.
Mažiesiems pažiūrėkite į kovalentines polines ir nepolines jungtis. Nukreipkite elementų užpakalį, kuris padės vaikams juos pamatyti.
Mažas. 3.
Mažas. 4. Kovalentinis nepolinis ryšys
2 vaizdo įraše galite žvilgtelėti ir išgirsti kovalentinį nepolinį žiedą
Prekės> Хімія> Хімія 8 klasėMalonumas
Koristuvachiv atkūrimo taisyklės svetainėje "ZNAK YAKOSTI":
Norėdami atsiimti koristuvachіv su jais, pasiimti: 111111, 123456, ytsukenb, lox і.т.п;
Norėdami vėl patekti į svetainę (sukurkite dvigubą paskyrą);
Susisiekite su užsieniečiais;
Susisiekite su kieno nors kito el. pašto adresais;
Elgesio taisyklės svetainėje, forume ir komentaruose:
1.2. Specialių pagerbimų pirmajam koristuvachivui paskelbimas anketoje.
1.3. Būti kaip destruktyvūs veiksmai, skirti ištekliui (destruktyvūs scenarijai, slaptažodžiai, sugadintos sistemos ir blogai).
1.4. Vikoristannya yak nikname nepadorių žodžių ir viraziv; vislov_v, kaip pažeidžia įstatymus Rusijos Federacija, etikos ir moralės normos; Jei frazės panašios į bet kurį administratorių ar moderatorių.
4. 2 kategorijos sunaikinimas: Baudžiama visa tvora bet kokio pobūdžio pasirodymo linijose iki 7 dB kryptimi. 4.1.Informacijos mažinimas, taip pat remiantis Rusijos Federacijos baudžiamuoju kodeksu, Rusijos Federacijos administraciniu kodeksu ir prižiūrint Rusijos Federacijos Konstituciją.
4.2. Propaganda bet kokia ekstremizmo, smurto, zhorstokost, fašizmo, nacizmo, terorizmo, rasizmo forma; tarptautinio, tarptautinio ir socialinio švietimo plėtra.
4.3. Neteisinga derybos dėl robotų ir vaizdų „YAKOSTI SIGN“ kuluaruose publikuotų tekstų ir pastabų autorių adresu.
4.4. Įkelti forumo dalyvių adresu.
4.5. Klaidingos informacijos platinimas, kniedės ir kitokio tipo pastatai, kaip nulaužti garbę ir aplankyti tiek žmones, tiek žmones.
4.6. Pornografija avataruose, kartais ir citatos, taip pat pornografiniai vaizdai ir šaltiniai.
4.7. Žiūrėkite diskusiją administratoriui ir moderatoriams.
4.8. Viešas svarstymas ir teisingų taisyklių vertinimas bet kokia forma.
5.1. Mat ir nešvankybės.
5.2. Provokacijos (specialūs vipadi, specialus diskreditavimas, neigiamos emocinės reakcijos formavimas) ir dalyvių skaičius deramasi (sistemingai pergalingos šimto procentų dalyvių provokacijos).
5.3. Provokuvannya koristuvachіv dėl konflikto po vieną.
5.4. Požiūrio į sp_vrozmovnik_v grubumas ir grubumas.
5.5. Eiti į asmenis ir z'yasuvannya specialių pranešimų forume.
5.6. Potvynis (identiškas arba nepasikeitęs)
5.7. Nėra jokios klaidos rašant slapyvardžius ir corystuvachi vardus išlavinta forma.
5.8. Cituojamos informacijos apie tai, kaip dainuoju tai zmist, sumažinimas.
5.9. Specialaus lapelio publikavimas be aiškiai išreikštos rėmėjo zgodos.
5.11. Destruktyvus trolinimas – tikslas yra iš naujo įgyvendinti derybas dėl susirėmimo.
6.1. Retkarčiais pervertinama (percituojama).
6.2. Vikoristannya į raudonos spalvos šriftą, skirtą moderatoriams taisyti ir gerbti.
6.3. Diskusiją tęsia moderatorius ir administratorius.
6.4. Tai dalis tų, kurie neturi tikslo jausmo arba provokuoja gyvatę.
6.5. Antraštę sukūrė tie, jei mano žemiškas... „Vinyatok“ nedrąsiai žiūri į post-temų antraštes ir tas, kurias paskelbė moderatoriai.
6.6. Parašo rašymas didesniu šriftu, žemesniu nei įrašas, ir parašo registravimas daugiau nei vienoje spalvų paletėje.
7. Sankcijos, kurios bus nustatytos prieš Forumo taisykles
7.1. Timchasova abo post_yna zaborona prieigą prie forumo.
7.4. Vidalennya obl_kovogo rekordas.
7.5. Blokuvannya ІР.
8. Užrašai
8.1. Moderatorių ir administracijos sankcijų saugojimas gali būti vykdomas be paaiškinimo.
8.2. Taisyklėse gali būti pakeitimų, apie kuriuos bus pranešta visiems svetainės nariams.
8.3. Koristuvacham zaboronyaєtsya vicoristovuvati klonai per valandą, jei pagrindinis slapyvardis yra užblokuotas. Klonas blokuojamas be eilutės, o pagrindinis slapyvardis pašalinamas iš dodatkovo dob.
8.4 Kai norite atkeršyti už nepadorią kalbą, ją gali redaguoti moderatorius arba administratorius.
9. Svetainės "ZNAK YAKOSTI" administracija pasilieka sau teisę matyti bet kokią progą ir be paaiškinimo. Svetainės administratorius pasiliko sau teisę redaguoti tarnautojo profilio paskyrą, nes jose esanti informacija atims iš jų forumo taisykles. Duomenys bus perduoti moderatoriams ir administratoriams. Administratorius turi teisę pagal poreikį keisti ar pridėti papildomų taisyklių. Taisyklių nežinojimas nėra girdimas dėl gedimo. Svetainės administratoriui nereikia perrašyti visos informacijos, kad ją paskelbtų. Kai tik tai matai, negali įsivaizduoti autoriaus minties, kad negali būti visų forumo dalyvių minčių įvertinimo nugalėtojas. Svetainės ir moderatorių pakeitimai є.
I. Cheminių jungčių klasifikacija
1. Už įžūlaus garso leidimo mechanizmo
a) obminniy Jei atomas yra įžeistas, tada paskambinkite, padarykite jai neporinį elektros ryšį.
Pavyzdžiui, molekulių su vandeniu H2 ir chloro Cl2 patvirtinimas:
b) donoras-akceptorius Jei vienas iš atomų reikalingas prijungimui, aš pasiruošęs pora elektronų (donoras), o kitas atomas - ištuštinti virtualią orbitą.
Pavyzdžiui, patvirtinant jonų amoniaką (NH4) + (dalis įkraunamas):
2. Dėl elektroninių orbitų recirkuliacijos metodo
a) σ - nuoroda (sigma) jei sukimo maksimumas yra ant linijos, kuri yra atomų centro apačioje.
Pavyzdžiui,
H2 σ (s-s)
Cl2 σ (p-p)
HCl σ (s-p)
b) π - garsas (pі) jei viršutinės srovės maksimumas yra ne tiesėje, o nuo atomų apačios centro.
3. Užbaigto elektroninio apvalkalo pasiekimo metodui
Odos atomas yra pragmatiškas, kad užbaigtų savo elektroninę odą, o būdas pasiekti tokią formą gali būti mažas.
|
Porvnyannya ženklai |
Kovalentinis |
Ionna |
Metaleva |
|
|
nepoliarinis |
poliarinis |
|||
|
Jakas pasiekia užbaigtą elektroninį apvalkalą? |
Uzagalnennya elektronіv |
Uzagalnennya elektronіv |
Tiesioginis elektronų perdavimas, jonų (įkrovimo dalelių) patvirtinimas. |
Uzagalnennya elektronіv usіma atomai Kristuje. ґratah |
|
Yaki priims atomo likimą? |
nime - nime EO = EO |
1) Nemetas-Nemetas1 2) Met-nimetas EO< ЭО |
met + [Nimet] - EO<< ЭО |
Universitetuose yra katijonų ir atomų metalai. Nuoroda skirta laisvai judėti elektronikos tarpcentrinėje erdvėje. |
|
∆c = EO1 - EO2 |
< 1,7 |
> 1,7 |
||
|
Užsidėk |
paprasti žodžiai – nemetalai. |
rūgštys, oksidai |
druskos, pievos, metalų oksidai |
paprasti žodžiai – metė. Metalų ir lydinių ryšiai, kurie akivaizdžiai stiprūs elektronuose ir metalo jonai metalo kristaluose. |
II. Kovalentinio ryšio esmė
Kovalentinis ryšys - nėra jungčių, bet nėra problemų tarp atomų nutolusioms elektroninėms poroms sukurti (pavyzdžiui, H2, HCl, H2O, O2).
Už nuotolinių elektroninių porų pakeitimo viena iš jų sujungtų atomų, kovalentinis ryšys gali būti poliarinisі nepoliarinis.
ІІІ. Kovalentinis nepolinis cheminis ryšys
Kovalentinis nepolinis ryšys (CNS) - padaryti vieno ir to paties cheminio elemento – nemetalinio – atomus(Pavyzdžiui, H2, O2, O3).
Komunikacijos mechanizmas
Galinėje elektroninio poravimo patalpoje parodytas odinis atomas su nemetalu. Nustatomi elektroniniai statymai. Elektroninė pora yra panaši į atomus.
Chloro molekulės tirpimo mechanizmas yra aiškus: Cl2– KNS.
Elektroninė Cl2 molekulės patvirtinimo schema:
Cl2 molekulės struktūrinė formulė:
Cl - Cl, σ (p - p) - viena grandis
Molekulės patvirtinimo demonstravimas
Molekulės nustatymo mechanizmas yra aiškus: O2 - kns.
Elektroninė O2 molekulės patvirtinimo schema:
O2 molekulės struktūrinė formulė:
O = O
π
Molekulė turi keletą subnuorodų:
Vienas σ (p – p)
tas vienas π (p - p)
Rūgštingumo ir azoto molekulių patvirtinimo demonstravimas
IV. Zavdannya už zakr_plennya
Zavdanya numeris 1. Pažiūrėkite į cheminius garsus įžeidžiančių žodžių molekulėse:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Zavdanya numeris 2. Parašykite H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2 molekulių patvirtinimo mechanizmą. Vienoje kovalentinėje jungtyje yra elektroninių chmarų (π arba σ) recirkuliacijos tipas, taip pat patvirtinimo mechanizmas (keitimas arba donoras-akceptorius)
Taip pat pažiūrėjome, kaip sujungti metalinių elementų atomus su nemetalinių elementų atomais: matome savo elektronikos pavadinimus ir atkuriame, kai kalbame apie teigiamus, o jie priima neigiamus. Juos trauks vienas prieš vieną, pasitenkins vienas spolukis.
O kaip gali būti ryšys tarp nemetalinių elementų atomų, kaip galiu nuleisti tendenciją prieš atvykstant elektros prietaisams? Nesunku pastebėti, kaip jungtis tarp to paties cheminio elemento atomų, pavyzdžiui, prie upių, gali turėti dviatomes molekules: azoto N 2, vandens H 2, chloro C1 2.
Pagarba, kad rodomas cich žodžių sandėlis papildomiems cheminiams požymiams, taip pat vikoristų indeksai.
Du identiški nemetalinio elemento atomai gali būti sujungti į molekulę tik vienu būdu: naudojant savo elektronų pavadinimus, kad jie skambėtų kaip abiejų atomų paslaptis.
Aišku, pavyzdžiui, fluoro molekulės F2 patvirtinimas.
Atomai fluoras – VII galvos grupės elementas (VIIA grupė) Periodinė cheminių elementų sistema D. I. Mendeleva – gegužė naujausiame energetiniame elektronų lygyje, o odos atomas nepasirodo iki jo pabaigos, atimdamas vieną iš elektronų. Fluoro atomo elektronų pavadinimai gali nustatyti tris elektroninius statymus ir vieną nesuporuotą elektroną:
Kai tik priartėja du atomai ir jų odoje yra vienas nesuporuotas elektronas, tada elektronai „susijungia“ ir tampa nutolę abiem atomams, kurių galūnės vadinamos aštuonių elektronų vaga.
Fluoro molekulės patvirtinimas parodytas diagramoje:

Yaksho pažymėkite elektroninę porą piešiniu, užrašykite struktūrinę formulę, pavyzdžiui, fluoro molekulės struktūrinę formulę
Panašiai kaip fluoro molekulėse, susidaro dviatomė vandens molekulė Н 2:

Slidus vrahuvati, kuris užbaigiamas atomui, bus dviejų elektronų r_ven, kuris pridedamas prie užbaigto atomo r_ven su heliu.
Struktūrinė molekulės formulė yra vodny
![]()
Leiskite mums patikslinti savo teiginį apie kovalentinį ryšį ant molekulės patvirtinimo užpakalis, vikoristovuyuchi supratimą apie elektroninį klouną (Div. § 9). Kai du atomai yra arti vienas kito, kai vienas s-elektroninis tamsumas yra sferinis, pamatysite elektroninio niūrumo nukreipimą. Esant įvairioms sąlygoms, plotas (pelės), neigiamo krūvio pobūdis yra svarbiausias, o dar labiau neigiamas krūvis. Teigiamo krūvio branduolys pritraukiamas prie jo (tuo pačiu fizikos metu) ir molekulė įsitvirtina. Esant tokiam rangui, linksmas garsas yra elektrinių jėgų serijos rezultatas. Tai aiškiai matyti viglyad schemoje:

Slydimas reiškia, kad žinant apie kovalentinį ryšį, kai randama joninė jungtis, yra antikrūvio krūvių režimas.
Pabaigoje matomas Mirkuvano algoritmas, reikia užrašyti kovalentinės jungties ryšio schemą, pavyzdžiui, azoto molekulei N 2.
1. Azotas yra V grupės galvos (VA grupės) taikinys. Jogo atomas gali turėti penkis elektronus naujausiu lygiu. Tačiau yra keletas nesuporuotų elektronų, kurie greitai veikia pagal formulę:
8 – N = nesuporuotų elektronų skaičius,
de N yra cheminio elemento grupės numeris.
Jau dabar azoto atomai gali pagaminti (8-5 = 3) tris nesuporuotas elektronikas.
2. Galima užsirašyti cheminių elementų požymius iš nurodyto tipo elektronų, kad nesuporuoti el.
![]()
3. Rašoma elektroninė molekulės struktūrinė formulė, kuri nurodyta:
Jei atomai yra susieti su viena elektronine pora, tada tokia kovalentinė jungtis vadinama viena, jei dvi - posluoksniu, o trys - vadiname.
Esant daugiau elektroninių porų nuo atomų iki molekulių, mažiau smirdančių yra susieta vienas su vienu, ir tai yra mažiausia iš atomų branduolių, kaip jie vadina antruoju žiedu. Fluoro molekulėse jungtis yra viena, o ryšys tarp atomų branduolių tampa 0,14 nanometro (1 nm = 10 -9 m, arba 0,000000001 m). Azoto molekulėse šansai ir galai tampa 0,11 nm. Norint suskaidyti azoto molekulę ant atomo, reikia apytiksliai septynis kartus vitruoti. daugiau energijos niz, skirtas atskiroms jungtims fluoro molekulėse nutraukti.
Pagrindiniai žodžiai ir žodžiai
- Atominis arba kovalentinis cheminis ryšys.
- Pavienės, pavaldžios ir reikalaujančios kovalentinės cheminės jungtys.
- Dovžino žiedas.
- Elektroninės ir struktūrinės formulės.
Robotas su kompiuteriu
- Prisijunkite prie elektroninių programų. Vivchit medžiaga pamokai ir vikonayte siūloma zavdannya.
- Žinokite internete elektroninius adresus, kurie gali būti papildomi manekenai, kurie atveria raktinių žodžių ir pastraipos žodžio kaitą. Padėkite skaitytojui ruošiant naują pamoką – sužinokite daugiau apie pagrindinius ir įžeidžiančios pastraipos žodžius.
Maitinimas ir tiekimas
- VII grupės (VIIA grupės) vadovų grupės pastangos Periodinė sistema D. I. Mendeleva (pidgrupy fluore) yra paprasti žodžiai, sudaryti iš dviatomių molekulių. Užsirašykite elektroninę diagramą, kurioje apžvelgsite tokių molekulių struktūrinę formulę, užburtą cheminį ženklą visoms maisto grupėms G (halogenas).
- Užrašykite kalbos cheminių jungčių nustatymo schemas, kurių sandėlis pavaizduotas formulėmis KS1 ir C1 2.
- Kiek nesuporuotų elektronų galite įsivaizduoti apie atomus? Kokia sąsaja bus S2 molekulėse? Užrašykite cheminio ryšio nustatymo S2 molekulėse schemą.
- Norėdami pagerinti cheminės medžiagos kokybę, naudokite formules S 2, Cl 2, N 2 ir patikrinkite savo sprendimo teisingumą. Jak zmіnyuvatimetsya dovzhina garsas molekulėse, sulankstytose jūsų eilėje?
- Kalbos augimas dviejose grupėse pagal cheminio ryšio tipą: N2, Li2O, KC1, O2, CaF2, H2.
Tema: kovalentinis nepolinis ryšys
Zavdannya:
Suformuluokite teiginį apie kovalentinę jungtį, kremas yra kovalentinis nepolinis ryšys;
Parodykite kovalentinio nepolinio ryšio sukūrimo mechanizmą;
Prodvzhiti vystymas min, analizuvati, robiti visnovka;
Vihovuvati splilkuvannya kultūra.
Ataskaitų teikimo motyvas ir tikslas:
Kokia yra azoto ir vandens prasmė dviatominėse molekulėse? Tobulėjimo ir geros sveikatos procese pristatymo tikslas grindžiamas pamokos tema.
Vivchennya nauja medžiaga:
Pažiūrėkime, kaip galime apsimesti, kad turime įžūlų molekulių žiedąCl 2.
Chloro atomas yraVIIAPeriodinių sistemų grupės, iš tos pačios, daugelyje elektronų naujausiame energijos lygyje, o jos užbaigimui nereikia dar vienos elektronikos. Keletas naujausio lygio elektronų atlieka statymą, o vienas atsiporuoja. Du chloro atomai, kaip vienas nesuporuotas elektronas, artėja vienas prie kito, elektronai „susijungia“ ir išlydo abu atomus; Galiu gauti porą elektron_v tik ryžių.
Tai kovalentinis ryšys arba atominis – cheminis ryšys, kuris yra išorinių elektroninių porų sukūrimo rezultatas.
Visas cheminis ryšys yra nustatytas tarp vieno ir to paties nemetalo atomų, su visais atliktais elektroniniais statymais, kad paprastame pasaulyje atsidurtų ant abiejų atomų, ir ant jų nebus pertekliaus, ir bus neturi būti neigiamo krūvio nepolinis.
Panašiai molekulė H 2. Tačiau atomas yra vidujeIAgrupe, tam odos atomas yra mazesnis nei vienas elektroninis ir iki finalo pabaigos energinga rіvnya yomu nevistachaє visų vieno elektrono (manau, atomams vandenyje ir heliui mes jį užbaigsime, kaip ant naujų 2 elektronų). Odos atomas gali būti prijungtas prie vieno elektrono vienu metu, o vienas elektronas nėra suporuotas, elektronai yra sujungti, ir aš atsiųsiu elektroninę porą, nes galima priskirti šabloną.
Be to, kai du atomai yra arti vienas kito, liesieji, vienas s-elektroninis niūrumas sferinės formos, matys elektroninio niūrumo kryžių. Tuo pačiu metu nustatomas plotas, didelė neigiamo krūvio talpa, prie jo pritraukiamas teigiamai įkrautas branduolys ir įsitvirtina molekulė.

Pažiūrėkime didesnės sulankstomos molekulės nustatymo mechanizmą 2 .
Kisenas yraPERgrupė, iš tos pačios, turime 6 elektron_v naujausio lygio. Ir vis dėlto, jei nesuporuotų elektronų skaičius yra didelis, galite vikoristovuvati formulę 8 -N, deN- Grupės numeris. Dermos atome bus 2 nesuporuoti elektronai, kurie dalyvaus nustatytame cheminiame žiede. Du nesuporuoti elektronai gali konkuruoti su dviem nesuporuotais to paties atomo elektronais ir atlikti du elektroninius statymus, todėl išmaniai galima vaizduoklyje įsivaizduoti dvi figas.
Rūgšties molekulėje esančių grandžių virpesiai yra saugomi dviejose elektroninėse porose, ir jie tai vadina poline, ji bus galingesnė, ji nėra viena, kaip molekulė yra vanduo. Vien tik intelekto poreikis, be mažytės jungties tarp atomų molekulėse, mažesnė tikimybė, kad būsime tarp atomų branduolių. Qia pradėta vadinti garsu prieš džiną. Paskutinis žiedas metro trumpesnis, ale labiau motsniškas. Pavyzdžiui, azoto molekulėje yra trečia grandis, tačiau norint suskaidyti molekulę į du atomus, reikia suvitruoti daug kartų daugiau energijos, o ne nutraukti vienintelę grandį chloro molekulėje.
Žinių publikavimas ir sisteminimas:
Kokia chemija vadinama kovalentine?
Ar tarp tam tikrų elementų atomų yra kovalentinis nepolinis ryšys?
Kokia kovalentinio ryšio nustatymo esmė?
Suskambinti vieną žiedą, kad būtų gautas iš antrinės bazės ir atliekos?
Parodysiu garsą ir kas turi atsigulti?
Žinių patvirtinimas ir kontrolė:
Pateikite kalbos molekulių patvirtinimo schemas: a) bromas; b) fluoro; c) azotas.
Pakeiskite odos eilutę:
a) CO 2 , NH 3 , P 4 , P 2 O 5 ;
b) Cl 2 , S, N 2 , CO 2 .
Žiūrėti:
a)P 4 ; b)Cl 2 , S, N 2 ... Grandinė su kovalentine nepoline grandimi.
Vibruoti kalba su kovalentine nepoline nuoroda:
P 4 , H 2 S, NH 3 , P 2 O 3 , S, N 2 , O 2 , H 2 O, HCl, H 2 .
Žiūrėti: kalbos su kovalentiniu nepoliariniu žiedu fiksuojamos tais pačiais nemetalų atomais, todėl busP 4 , S, N 2 , O 2 , H 2 .
Refleksija ir pіdbittya pіdsumkіv:
Jakas vi vvazhaєte, jakas išmoko pamokos medžiagą? geras; b) geras; c) geros būklės; d) neįsigijo.
Kaip iš karto gauti maitinimo šaltinį, kaip jį padėjote ant burbuolės pamokai?
Namų darbai:
ašрівень: §11, ex. trylika;
IIr_ven: tezh + pratimas. 4, 5.