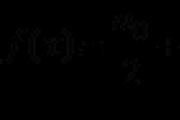Objem modrých plynov v chemických reakciách. Avogadrov zákon
Rečový tábor podobný plynu. Avogadrov zákon. Molárny objem plynu.
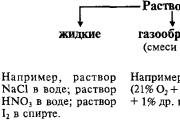
Reč je možné recyklovať v troch mlynoch na agregáty – pevné, vzácne a plynné. Častice v tom počte sú zložené z tvrdej reči, aby medzi sebou urobili mitzno pov'yazan, k tej tvrdej reči tvoria jednotnú formu. Časti pevných telies môžu byť atómy, molekuly, ióny, ktoré tvoria kryštálové štruktúry. Qi chastki kolivayutsya s malou amplitúdou bitie vuzlіv kryštalické ґrat. V rodných krajoch sú diely zviazané jedna k jednej slabšie a dajú sa prezliecť, aby bol veľký rozdiel. Z tohto dôvodu plinist a napučiava formy sudcov, v ktorých je smrad známy.
Prechod reči z pevnej látky sa počas zahrievania zriedka pozoruje, v dôsledku čoho sa postupne zvyšuje amplitúda štiepenia častíc. Pri vysokej teplote častice reči napučia zdatnosťou, prehlušia uzly otrepu, pozoruje sa topenie. Keď sa ochladí, navpaki, časti rіdini trávia zdatnіst pohyb a zafixovanie v speváckej polohe, vďaka čomu je reč pevná. Pre najväčšie mozgy rіdini spravidla dria molekulárny život. Pri vysokých teplotách môže byť štruktúra rіdini odlišná (tavenie solí a kovov).
Interakcie medzi molekulami bohato slabé, nižšie medzi iónmi v iónových kryštálových štruktúrach; atómy viazané kovalentnou väzbou v atómových štruktúrach; kovové ióny, viazané elektrónovým plynom v kovových štruktúrach.
Pevný a vzácny tábor reči, aby sa odvážne meno kondenzačný mlyn. Hrúbka reči v kondenzovanej oceli sa mení na hraniciach približne 0,5 - 22,5 g / cm3. Reč na čerpacej stanici môže mať výrazne menšiu hrúbku - blízko 10 -2 - 10 -3 g / cm3. Prechod na plynovom mlyne je spôsobený ohrevom rečí, ktoré sú v kondenzovanom mlyne (varenie pevných látok, sublimácia tvrdých rečí). Plynové pre tých najväčších rečníkov sa skladajú z molekúl.
Pri prechode do stavu podobného plynu častice reči pridávajú sily medzimolekulovej interakcie. Obsyag, ktorý zaberá plyn, ktorý v skutočnosti zakrýva voľný priestor medzi molekulami plynu, ktoré sa náhodne zrútia. Veľkosť tohto priestoru je určená teplotou a zverákom. Keď sme obsyagom, obsadené samotnými molekulami, môžeme sa vzbúriť. hviezdy kričia Avogadrov zákon :
Rovnaké záväzky rôznych plynov majú rovnaký počet molekúl pre rovnaké mysle.
Zo zákona Avogadro kričať dva hlavné zistenia .
Prvý dôsledok
Jeden mól akéhokoľvek druhu plynu pre tie isté mysle si požičiava rovnaký prísľub. Tsey obsyag sa nazýva molárny tlak plynu ( V m ) , Čo je vimiryuetsya v m 3 / mol (často v dm 3 / mol). Molárny záväzok voči plynu je pokročilejší, aby zaviazal plyn k rovnakému množstvu:
Vіdomo, scho hodnota V m na spadnutie vіd mysli (teplota, tysk). Na splnenie úlohy je potrebné zapamätať si hodnotu V m at normálne mysle (n.o.s.) - atmosférický tlak (101,3 kPa) a teplota ľadu (0 0 C alebo 273,15 K).
Pre normálne mysle V m \u003d 22,4 dm 3 / mol, alebo
v jednotkách CI 0,0224 m 3 / mol.
Ďalší dôsledok
Šírky plynov (alebo hmotnosti tých istých plynov) sú spojené ako molárne hmotnosti plynov.
Môžete to vidieť z takýchto zrkadiel. Prineste si dve časti rôznych plynov rovnakej povinnosti (povinnosti vimiryanov pre rovnaké mysle). Poznáme ich:
Nastavenie їх hmotnosti:
Yakshcho vikoristovuvat schіlnіst:
Za Avogadrovým zákonom n 1 \u003d n 2, pozri:
Zmena hrúbky plynov, ktorá je drahšia pri zmene molárnych hmotností, sa nazýva nosnosť jedného plynu v druhom ( D ). D - hodnota nie je definovaná.
Keď poznáme D a molárnu hmotnosť jedného plynu, je ľahké poznať molárnu hmotnosť iného plynu:
; M1 = M2 × D.
uplatniť
M(x) = M(H2) × D = 2 × 8,5 = 17 g/mol
Plyn z takejto molárnej hmotnosti - amoniak NH 3 .
Sila určitého uhľohydrátu podobného plynu sa ukáže byť drahšia pre dvoch. Zmeňte svoju molárnu hmotnosť na sacharid.
Priemerná molárna hmotnosť sa zdá byť 29 g/mol.
M(x) = M(p.) × D = 29 × 2 = 58 g/mol
Sacharid s takouto molárnou hmotnosťou je Z 4 H 10 bután.
Všimnite si, že plyny s molárnou hmotnosťou menšou ako 29 sú jednoduché na opakovanie, viac ako 29 je dôležitých.
V rastlinách rozrahunkovyh môžu byť údaje o dusíku, kyslosti a iných plynoch. V tomto prípade je pre hodnotu molárnej hmotnosti potrebné vynásobiť viskóznu hrúbku molárnou hmotnosťou, podobne ako dusík (28 g / mol), kyslé (32 g / mol) atď.
Avogadrov zákon je široko používaný v chemických štúdiách. Oskіlki pre plyny sú úmerné počtu prejavov, potom koeficienty v rovnakých reakciách, ktoré odrážajú počet reagujúcich prejavov, úmerné podielom rušivých plynov. Je zrejmé, že scho obsyagi mayut, ale vimiryan pre rovnaké mysle.
zadok
Na odlupovanie 2 dm bude treba nejaký kyslý 3 propán? Vymiryan obyagi pre n. r.
H3H8 + 502 3C02 + 4H20.
Z Avogadrovho zákona je jasné, že rovnaký počet rôznych plynov by sa mal rovnať rovnakému počtu molekúl a, samozrejme, rovnakému počtu mólov reči. Dajme tomu propánu až 1 dm3. Todi, z rovnakej reakcie, na obarenie 1 dm 3 propánu potrebuje 5 dm 3 kyslého a 2 dm 3 (dva litre) - 10 dm 3 Pro 2.
Chémia
Globálna chémia
Základné pojmy, zákony a teórie chémie
Objem modrých plynov v chemických reakciách. Avogadrov zákon
Gay-Lussacov zákon peňazí
Gazi na seba reagujú pri piesňach všeobecnej reči. V roku 1808 p. J. L. Gay-Lussac, ktorý stanovil toto pravidlo: Množstvo plynov, ktoré vstúpia do reakcie, možno vidieť jeden k jednému z týchto plynom podobných produktov v reakcii, ako malé čísla.
Vіdkritiy vchenim zákon vіdomy v chémii jaka zákon objemov b. Pre jogu je potrebné, aby sa plyny, ktoré sa zúčastňujú reakcie, udržiavali pri rovnakej teplote a tlaku.
Vіdnoshennya obsyagіv gazіv, scho vstúpiť do chemickej reakcie, vіdpovіdat koeficienty rovnaké, napríklad: .
V tomto prípade reagujú 3 objemy vody s 1 objemom dusíka, v dôsledku čoho sa rozpustia 2 objemy amoniaku, takže sa prejavuje spontánnosť.
manažér. Aká je potrebná reakcia vody na 2 m 3 dusíka?
Riešenie
Z rovnakej reakcie je zrejmé, že na vine je objem vody, ale objem dusíka je trikrát väčší:
obsyag vody m3.
Avogadrov zákon
Na vysvetlenie jednoduchého spіvvіdnoshenі mіzh vzyagyah reagujúcich plynov vikoristovuyut Avogadrov zákon: Rovnaké väzby rôznych plynov pre rovnaké mysle (teplota a tlak) majú rovnaký počet molekúl.Nenechal som Avogadrov zákon zapískať dvakrát ta:
1) Jeden mól akéhokoľvek druhu plynu pre rovnaké mysle požičiava rovnaký záväzok.
Pre normálne mysle (n.a.) potom pri teplote 273 K a naopak 101,3 kPa (1 atm) zaberá 1 mol akéhokoľvek plynu objem, ktorý sa rovná 22,4 litrom. Tsei obsyag hovor molárny plyn i znamená l/mol.
Molárna väzba sa môže uvoľniť pomocou vzorca
.
2) Pri konštantnom tlaku je teplota plynovej medzery menšia ako jedna molárna hmotnosť.
Tse vám umožňuje nepochopiť priepustná hrúbka prvý plyn iným spôsobom:
,
de D- viditeľne schilnista, ako ukazuje, zároveň je prvý plyn dôležitý pre druhý pre rovnaké mysle.
Najčastejšie je viktorista schopný vidieť vodu cez plyn. Todi:
; .
Je možné uvoľniť hustú húštinu pre akýkoľvek druh plynu.
Koho distribúcia vikoristánskych materiálov metodický asistent"Navchannya rozvyazannyu problémy chémie". Autori - administrátori: učiteľ chémie najvyššej kategórie, metodik Inštitútu pre vzdelávanie "Gymnázium č. 1 mesta Grodno" Tolkach L.Ya.; metodička počiatočno-metodického oddelenia Inštitútu vzdelávania "Grodno OIPK a PRR a SV" Korobova N.P.
Výpočet počtu molárnych objemov plynov.
Výpočet výraznej húštiny plynov.
Objem modrých plynov
Jeden mól akéhokoľvek druhu plynu pre tie isté mysle zaberá ten istý. Takže pre normálne mysle (n.o.),tobto. pri teplote 0 °С a normálny atmosférický tlak, ktorý je 101,3 kPa, jeden mól akéhokoľvek plynu zaberá objem22,4 dm3.
NastaveniePlyn zaväzujem k určitej chemickej kvantite reči – hodnote, ako sa tomu hovorímolárny tlak plynu (Vm):
Vm = V/ ndm 3, hviezdičkyV = Vm · n
Aby ste si vybrali: najľahší alebo najdôležitejší plyn sa rovná druhému plynu, stačí vyrovnať ich hrúbku:
r 1 / r 2 = M 1 V 1 / M 2 V 2 = M 1 / M 2 = D 2.Z pohladu indukovaneho virazu je jasne: vyrovnať šírku plynov, dosiahnut vyrovnanie ich molárnych hmotností.
Pomer molárnej hmotnosti jedného plynu k molárnej hmotnosti iného plynu je hodnota, ako sa nazýva
vnímateľný priestor ( D 2 ) jeden plyn s druhým plynom.Keď poznáte silu jedného plynu v druhom, môžete vypočítať molárnu hmotnosť:
M
1 = M 2 · D 2 .Ak vidíte súčet plynov, potom sa táto „molárna hmotnosť“ rovná hmotnosti s objemom 22,4 litra. Hodnota Tsya je číselne pokročilejšia:
M pov. = 29 g/mol
Zjavne, až do Avogadrovho zákona, rovnaký počet molekúl rôznych plynov pre samotné tiché mysle zaberá rovnaké množstvo.
Z toho vyplýva ďalší dôsledok.
Pri konštantných teplotách a tlaku začnú plyny reagovať jedna ku jednej a tiež v rozsahu plynom podobných produktov, ktoré sa usadzujú ako malé množstvá.
Tento zákon sformuloval Gay-Lussac ako zákon objemu plynov. Týmto spôsobom, ak sa podieľa chemická reakcia alebo sa objaví reč podobná plynu, potom pre rovnaké reakcie je možné inštalovať objemy modrej.
Obsyagi plyny, na ktoré reagujú, sú úmerné chemickým množstvám týchto prejavov:
V 1 / V 2 = n 1 / n 2 tobto. V 1 a V 2
číselne rovnaké koeficienty rovnakých reakcií.príklad 1. Balónik pojme 0,5 kg stlačenej vody. Aký objempožičať si také veľké množstvo vody? zmyť normálne.
Riešenie:
1. Vypočítajte chemické množstvo
voda, čo pomstiť v balóne:N
(H 2) \u003d 500/2 \u003d 250 (mol), de M (H2) \u003d 2 g/mol.2.Oskіlki pre normálne mysle 1 mol akéhokoľvek plynu zaberie celkom 22,4
dm 3, potomV = Vm · n, V( H 2 ) = 22,4 * 250 = 5 600 (dm 3)
Vidpovid: 5600 dm 3
Zadok2. Aký sklad (v %) medzizliatiny hliníka, ako pri testovaní 1 g nadbytku kyseliny chlorovodíkovej jódu, bolo vidieť 1,18 l voda?
Riešenie:
1. Len hliník môže vstúpiť do reakcie s kyselinounapíš rovné:
2A1 + 6HC1 = 2A1C13 + 3H 2
2 mol 3 mol
2. Vypočítateľné chemické množstvo voda:
n(H 2 ) = 1,18/22,4 = 0,05 (mol)
3. Na základe reakcie vypočítame hmotnosť hliníka,čo skrývať v zliatine:
3 mol 2 mol hliníka
0,05 mol vidieť vodu, akoby reagovaťXmol hliníka
x \u003d 0,05 2/3 \u003d 0,033 (mol),
m( Al) = 0,035 27 = 0,9 (g), de M (Al) = 27 g/mol
5. Vypočítateľné hmotnostný podiel hliníka v kove:
w(ALEl) = m ( Al ) / m (zliatina) , w( A1) = 0,9/1 = 0,9 chi 90 %.
Todi hmotnostný zlomok midi zliatiny 10%
Typ: 90% hliník, 10% midi
príklad 3. Výrazne rozlíšiteľná sila: a) zopakujem to,b) oxid uhličitý voda.
Riešenie:
1. Je známe, že keď sa naň pozriete, uvidíte kyslosť:
D povit (Pre 2) =M(Pro 2)/M (pov.) = 32/29= 1,1.
2. Prítomnosť oxidu uhličitého môžeme vidieť podľa voda
D H2 (C02) =M(Z 2 )/M(H 2) \u003d 44/2 \u003d 22.
Vidpovid: 1,1; 22
zadok 4. Určte objem plynov, ktoré pridajú do 0,5 mólu kyslosti, 0,5 mólu vodya 0,5 mólu oxidu uhličitého.
Riešenie:
1. Chemické množstvo súčtu plynov poznáme:
n(súčet) \u003d 0,5 + 0,5 + 0,5 \u003d 1,5 (mol).
2. Vypočítajte celkové množstvo plynov:
V(sumish) \u003d 22,4 1,5 \u003d 33,6 (dm 3).
Šírka: 33,6 dm 3 sumy
Príklad 5. Vypočítajte objem oxidu uhličitého, ktorý sa uvoľní pri vypľuvaní 11,2 m 3 metán CH4.
Riešenie:
1. Napíšte chemickú reakciu horenia metánu:
CH4 + 202 \u003d CO2 + 2H20
1 Krtko1 Krtko
1 m 3 1 m 3
2. Na výpočet množstva oxidu uhličitého spočítame a zmeníme pomer:
pri spánku 1 m 3 CH 4 weide 1 m 3 2
pri spaní 11,2 m 3 CH 4 vide x m 3 2
x \u003d 11,2 1/1 \u003d 11,2 (m 3)
Vidpovid: 11,2 m 3 oxid uhličitý
Príklad 6. Oceľový valec na zachytávanie vylisovaných plynov bol naplnený vzácnou kyslou hmotou s hmotnosťou 8 kg.
Aký obsyag si požičal plyn z čerpacej stanice (n.o.)?
Riešenie:
1. Vypočítajte chemické množstvo vzácneho kyslého:
n( O 2 ) = 8000/32 = 250 (mol).
2. Výpočet kyseliny podobnej plynu:
V( O 2 ) \u003d 22, 4 250 \u003d 5 600 dm 3.
Vidpovid: 5600 dm 3
Príklad 7. Vypočítajte hmotnosť podľa objemu 1 m 3 (n.o.), čo je 78 objemov dusíka, 21 - kyslý, 1 - argón (krym iných plynov).
Riešenie:
1. Vyhodyachi z zavdannya, obsyagi gazіv vіtrі vіdpovіdno dorovnyuyut:
V( N 2 ) \u003d 1 0,78 \u003d 0,78 m 3;
V(Pro 2) \u003d 1 0,21 \u003d 0,21 m 3
V(ALEr) \u003d 1 0,01 \u003d 0,01 m 3.
2. Vypočítajte chemické množstvo kožného plynu:
n( N 2 ) \u003d 0,78 / 22,4 10 -3 \u003d 34,8 (mol),
n(Pro 2) \u003d 0,21 / 22,4 10 -3 \u003d 9,4 (mol),
n(ALEr) \u003d 0,01 / 22,4 10-3 \u003d 0,45 (mol).
3. Vypočítajte hmotnosť plynov:
m(N 2 ) = 34,8 28 = 974 (g),
m(Pro 2 ) = 9,4 32 = 30 (g),
m(ALEr) = 0,45 40 = 18 (d).
4. Vypočítajte hmotnosť zakaždým:
m(Opakovať) \u003d 974 + 301 + 18 \u003d 1293 (g) alebo 1,293 kg.
Hmotnosť: 1,293 kg za deň
Príklad 8. Keď podpalyuvanni v evdiometrі sumish kyslé a vody s objemom 0,1 m 3 celková suma sa zmenila o 0,09 m 3 .
Yaki sľubujevoda a kyslé boli na výstupe sumishi, ako plyn, čo zostalo, horí (n.o.)?
Riešenie:
1. Napíšte rovnakú reakciu:
2H 2 + Pro 2 = 2H 2 Pro
2 mol 1 mol 2 mol
2. Je zrejmé, že plyny, ktoré vstúpili do reakcie.
spáchaný plynový vak sa ponáhľal po rahunku sladkej vody, do ktorej plyny, ktoré vstúpili do reakcie, dosiahli 0,09 m 3 .
Pretože gasi vstúpiť do reakcie rýchlosťou 2:1, potom od 0,09 m 3 dve časti
spadnúť na vodu a jeden - na bozku. Otec, reaguj
zadaných 0,06 m 3 vody a 0,03 m 3 kyslé.
3. Vypočítajte množstvo plynu v celkovom množstve.
Pretože plyn, ak preteká, horí, tak celý deň je 0,01 m 3 .
V(H 2 ) = 0,01 + 0,06 = 0,07 (m 3 ) alebo 70 l,
V(Pro 2 ) = 0,1 - 0,07 = 0,03 (m 3 ) alebo 30 l.
Odporúčanie: 70 litrov vody, 30 litrov kyslej
Príklad 9. Aký je rozdiel medzi množstvom vody v plynnej zmesi, do ktorej sa pridáva až 56 litrov argónu a 28 litrov dusíka (n.o.)?
Riešenie:
1. Vyhodyachi z vyznachennya vіdnoї gustina gazіv,
D H 2 = M (bláznivý) / M(H 2 ).
2. Vypočítajte chemické množstvo a hmotnosť súčtu plynov:
n(Ara) = 5,6/22,4 = 2,5 (mol);
n(N 2 ) = 28/22,4 = 1,25 (mol);
n(súčet) \u003d 2,5 + 1,25 \u003d 3,75 (mol).
m(Ar) = 2,5 40 = 100 (g),
m(N 2 ) = 1,25 28 = 35 (g),
m(súčet) \u003d 100 + 35 \u003d 135 (g), pretože
M(Ar) = 40 g/mol, M (N 2 ) = 28 g/mol.
3. Vypočítajte súčet molárnej hmotnosti:
M(sumish) = m (bláznivý) / n (bláznivý) ;
M (súčet) \u003d 135 / 3,75 \u003d 36 (g/mol)
4. Vypočítajte celkové množstvo plynu vo vode:
D H 2 = 36/2 = 18.
Dátum: 18
zadok 10. Dokážete spáliť 3 g drevenej vagíny na trojlitrový bantz naplnený kyslou (n.o.)?
Riešenie:
1. Zapíšte rovnakú reakciu horského vugila:
W + Pro 2 = SO 2
1 mol 1 mol
2. Vypočítajte chemické množstvo vugillu:
n(S) = 3/12 = 0,25 (mol), takže M (C) \u003d 12 g / mol.
Chemické množstvo kyslého, potrebného na reakciu, bude tiež rovnaké 0,25 mol
3. Vypočítajte objem kyslej látky potrebnej na rozpálenie 3 g vodky:
V(O 2 ) = 0,25 22.4 = 5,6 (1).
4. Oskіlki plyn požičiava objem nádoby, v rovnakom víne je známe, є 3 litre kyseliny. Otzhe, nezošívaj kilko pre spalyuvannya 3 g vugillya.
Tip: nezošívajte
zadok 11. Koľkokrát zvýšiť objem vzácnych vôd v budúcnosti premeny na pár pri n.s.?
Pre chemické reakcie aA + bB = cC + dD
zobúdzať sa
de nA a nB sú počet voľných prejavov, ktoré zareagovali, ps a nD sú počet produktov, ktoré boli rozpustené, a, b, c a d sú stechiometrické koeficienty.
Z množstva prejavov je ľahké prejsť na їх omšu:
Pre prejavy podobné plynom je bežnejšie nastaviť chi na označenie ich povinností. Ak sú činidlom a produktom D plyny, vykonajte prechod z počtu kostí týchto prejavov na ich:
![]()
Pre vіdomih (per mind) množstvo, masi alebo oblige (pre plyn) jeden z prejavov, ktoré sa zúčastňujú reakcie, je možné odvodiť hodnoty všetkých veličín pre iné prejavy.
Pri rôznych sumách plynov A a B, z ktorých jeden sa zúčastňuje reakcie, môžete poznať sp_v_dnoshnenja їkh obsyagіv VA: VB a pre daný sp_vv_dnoshnі - їkh obsyag sumіshi (alebo navpaki).
Butt rozvyazannya úlohy
Pri vysokej teplote horčík reaguje s dusíkom, pozrime sa na sumu argónu, s celkovým objemom 5,6 l (n.o.) a pridáme 15 g nitridu. Vypočítajte objem plynov V(N2): V(Ar) na výstupnom súčte.


Úloha pre nezávislé riešeniečasť A
1. 6 l oxidu dusnatého (II) zreagovalo s 5 l kysl
2. V uzavretej nádobe sa vypálilo 24 g grafitu v 67,2 l (n.a.) kyslej a odobral sa objem kyslej: produkt je rovnaký
3. Cez ozonátor prešlo 7,5 mol kyslého, ktorý sa často menil na ozón. Zostáva po farbení na „vysolenie“ (pre normálne mysle) 0,5 mol krvnej vody (návrat do SO2); neskôr sa objem O3:O2 na výstupe z ozonizátora stal
4. Bromid draselný s hmotnosťou 142,8 g, ktorý trochu reagoval s chlórom, ho vezmeme v rovnakom počte opakovaní v objemovom pomere 1 (chlór): 2 (opakovanie). Galny obsyag (v litroch)
5. Na úplné spálenie 17,92 l (n.o.) sumish CH4 + H2 bol potrebný 1 mol kyslého. Na konci dňa je celkové množstvo CH4:H2 výraznejšie:
6. Plyn A, pri pražení 0,04 mol KClO3 na katalyzátore sme odobrali (u n.a.) nádobu s plynom B, čo bolo vidieť, keď sme skúšali 6g vápnika s vodou a odobrali súčet objemov A: B, rovné
7. Po vyplivnutí nitrobenzénu v prebytku kyslosti súčtu produktov (dusík, oxid uhličitý, voda), v ktorom sa odstránia 4 litre (n.a.) dusíka a objem N2:O2 je väčší ako 4:1 v litroch , n . u.) kysnúť
8. Prevedený tepelný rozklad 1 molu chloridu amónneho v oceľovom balóne, ktorý obsahoval aj 11,2 l (n.a.) amoniaku. Kіntseve ob'єmne vіdnoshennia NH3: НCl dorovnyuє
9. Sumish kyslý a chlór s objemom 9:1 vikoristán pre videnie 0,5 mol jednoduchej reči s rozsahom KI
10. Kissen prechádzal ozonátorom, kedy sa na katalyzátore pražil 1 mol KClO3, pri pražení 5% kyslého sa kyslé zmenilo na ozón a na výstupe z ozonátora sa objem O2:O3 znížil.
Fyzikálno-chemické zákonitosti formovania tenkotavných kov-polymérnych systémov z plynnej fázy
Tenkotavené kov-polymérové materiály (kovové polyméry, kovové dosky s tenkými polymérnymi povlakmi, bohaté guľôčkové systémy atď.), ktoré sú lisované vákuovou technológiou.
Epitaxný rast Ge na Si(100) povrchoch
Z fyziky tenkých vrstiev je možné dospieť k perspektívam ďalšieho rozvoja mikroelektroniky, optiky a ďalších aplikácií novej techniky. Úspechy mikroťažby elektronických...
Komponenty, ktoré môžu byť výkonné a znižujú horľavosť polymérnych materiálov
O chvíľu neskôr bude ekonomika krajiny zachránená od stoviek miliónov rubľov. Pri spaľovaní polymérnych materiálov je to vidieť veľké číslo toxické plyny, ktoré sú škodlivé pre ľudí a ...
Ciele lekcie:
Kontrola namiesto dokumentu
„Trieda chémie 9 Objemy modrých plynov v chemických reakciách. Výpočet celkovej spotreby plynov pre chemické rovnosti.
Lekcia chémie na tému „Objem modrých plynov v chemických reakciách. Výpočet celkovej spotreby plynov pre chemické rovnosti“
Lekcia č. 3 o technike kritického myslenia
Ciele lekcie: získať poznatky o zákone objemov vody pre plyn podobnú reč na základe chemických reakcií organickej reči; tvoria zákon o'mnih spіvvіdnoshen pre rozrahunkіv іz khіmіchnyh rivnyan. Dodoskonaljuvati vminnya uchnіv virіshuvati rozrakhunkovі zavdannya shdo rіvnyan khіmіchnih reaktsіy. Rozvinúť vmіnnya uchnіv sklad khіmіchі zavdannya. Rozvíjajte kritické myšlienky. Vytvorte pozitívne nastavenie, kým sa objekt nedokončí, zhrnutie nastavenia pred koncom úlohy.
Vlastníctvo: karty úloh.
Skrytá lekcia.
ja.Rozcvička(Študenti sa strácajú vo svojich myšlienkach)
A. Frans „Ak si človek myslí, nebude nadšený, ale nebude očarený, ak...“
Ako ste dokončili túto vetu?
Naučte sa cvičiť v skupinách. Napíšte navrhované možnosti. Vyberte si tі, yakі na їhnyu dumku fit viac.
Višnovok: "Ak človek myslí, nebude zmätený, ale nebude spievaný, ak áno."
I spodіvayus, scho na pravej strane, s ktorým sme na lekcii zaneprázdnení, aby som ťa zasiahol a ty ukážeš svoju silu v prítomnosti.
II. Motivácia k vzdelávacej aktivite.
Ohromený tými, ktorí vedú lekciu.
S. Kroky aktualizácie
Za diagramom V_den hádajte chemickú silu alkenіv a alkіnіv.
Prečo sa staráš molárna kontrakcia akýkoľvek plyn pre n.s.
Návrh: 22,4 l/mol
Ako je formulovaný Avogadrov zákon?
Návrh: Pri rovnakých povinnostiach rôznych plynov, pre rovnaké mysle (t, p) sa pomstí rovnaký počet molekúl.
Višnovok: Množstvá plynných činidiel a produktov reakcie sú koordinované tak, ako sa ich koeficienty v reakcii rovnajú. Tsya zakonіrnіst vikoristovuєtsya pre khіmіchnyh rozrahunkіv.
Kreatívna úloha:(Dáva vám príležitosť prehodnotiť so silnými znalosťami vedcov na túto tému)
V troch očíslovaných skúmavkách, uzavretých zátkami, є: metán, etylén, acetylén. Ako rozpoznať, kde je plyn poznať?
IV. Kroky oznámenia(Privádzanie k poznaniu látky, ktorá je založená na problémoch, hľadanie pravdy).
Prednáška („kolotoč“ bola posilnená: základné pochopenie toho, ako prebieha svadobný deň na začiatku; po jeho skončení sa študenti spoja v stávke, vyhrajú podobné úlohy; zostavia podobné úlohy, ako napríklad súdny deň atď. .)
Objem chlóru (n.o.) na reakciu so 7 litrami propénu je:
a) 14 l; b) 10 1; c) 7 1; d) 22,4 litra.
3. Vypočítajte si celkovú sumu peňazí, ktorú potrebujete na spálenie sumishi,
pridáva až 5 l etylénu a 7 l acetylénu (n.o.).
Uveďte, aký objem vody je potrebný na úplnú hydrolýzu 7 litrov etylénu, kým nebude reakcia rovnaká:
Z2H4 + H2 \u003d Z2H6 a) 7 l; b) 6 1; c) 14 1; d) 3,5 litra.
Páry pracujú.Študenti, zjednotení v stávke, zostavili podobné príkazy ako pár virishu sudidnya:
Objem vody potrebný na úplné zaliatie je 15 litrov butínu, viac: a) 15 litrov; b) 30 1; c) 7,5 l; d) 3,5 litra.
Do 5 l acetylénu sa pridá akýkoľvek objem chlóru v závislosti od reakcie C2H2 + 2Cl2 \u003d C2H2Cl2
a) 5 1; b) 10 1; c) 2,5 l; d) 22,4 litra.
3. Vypočítajte celkové náklady, pretože je potrebné vynaložiť na šetrenie
10 m3 acetylénu (N.O.).
V. Reflexia
Vikonannya úloha z karty.
Vypočítajte celkové množstvo vody, potrebu opakovaného zavlažovania reči X.
(Naučte sa samostatne vyplniť tabuľku, po dokončení práce odpovedia na otázky).
| Obsyag reč X, l | Rečový vzorec X | Rivnyannya gidrovannya | voda, l |
|
VІ . Visnovki z lekcie
Úloha nadchádzajúcej lekcie je formulovaná.
VІ ja. Vrecká na lekciu
VIII. Domáca úloha
Propratsiuvati odsek 23, vikonati vpravo 206, 207 na boku.