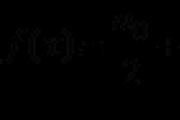Ege chémia dema. Triviálnosť ЄDI z chémie
14.11.2016 Rock na stránke FIPD zverejnené a zverejnené demonštračné možnosti, kodifikuje a špecifikuje kontrolné materiály jedného suverénneho spánku a hlavného suverénneho spánku roku 2017 vrátane chémie.
Demo verzia ADI z chémie 2017 s aktualizáciami
| Možnosť závod + vidpovidі | Pridať demo verziu |
| Špecifikácia | demo variant himiya ege |
| kodifikátor | kodifikátor |
Demo verzie ADI z chémie 2016-2015
| Khimiya | Pridajte demo + aktualizácie |
| 2016 | ege 2016 |
| 2015 | ege 2015 |
V KIM, v roku 2017, bolo veľa sutt, takže ukážky z minulosti rocky boli vyzdvihnuté pre informáciu.
Chémia - zmeny sutta: Optimalizovaná štruktúra náhradného robota:
1. Štruktúra 1. časti KIM bola zásadne zmenená: bol umožnený výber jedného zobrazenia; zavdannya zgrupovany pre okremim tematické bloky, v dermálnej zóne є zavdannya yak základné, takže і pokročilé ravnіv skladanie.
2. Zmenený počet budov zo 40 (2016 s.) na 34.
3. Hodnotiaca škála (od 1 do 2 bodov) bola zmenená na určenie základnej úrovne skladania, ktorou je zopakovanie poznatkov o genetických väzbách anorganickej a organickej reči (9 a 17).
4. Maximálny prvý bod za výhru robota je viac ako 60 bodov (namiesto 64 bodov v roku 2016).
Triviálnosť ЄDI z chémie
Triviálnosť vyšetrenia výmeny robotov v sklade je 3,5 roka (210 khvili).
Približne po hodine, keď je návštevník predstavený, sa stáva:
1) pre kožu zavdannya základná úroveň skladacích častí 1-2-3 chilini;
2) na starostlivosť o pleť p_advishennogo rivnya skladacie diely 1-5-7 chilin;
3) pre starostlivosť o pleť s vysokou úrovňou skladania, 2-10-15 čili.
Špecifikácia
kontrolné materiály
za držanie rosi slobodného suverénneho spánku v roku 2017
z ХІМІЇ
1. Vymenovanie KIM ЄDI
Single State Sleep (dal - ЄDI) є formou aktívneho hodnotenia kvality tréningu pre jednotlivcov, ktorí zvládli stred. domáce pokrytie, Na základe zavedenia štandardizovaného formulára (kontrolné materiály).
DI sa vykonáva v súlade s federálnym zákonom z 29. decembra 2012 č. 273-FZ "O vzdelávaní v Ruskej federácii".
Kontrolné materiály umožňujú stanoviť úroveň zvládnutia štátneho štandardu stredného (všeobecného) zahraničného vzdelávania v chémii na základnej a odbornej úrovni absolventmi federálnej zložky.
Výsledky One suverénnej nemocnice v chémii budú uznávané vzdelávacími inštitúciami strednej odborné vzdelanie a výsledky úvodných testov z chémie.
2. Dokumenty pre viznachayut zmist KIM ЄDI
3. Prejdite na výber zmist, štruktúru KIM EDI
Základom pre vývoj KIM ЄDI 2017 r. z chémie vydávajú metodické inštalácie, ako sú hodnoty v priebehu formovania Preskúmané modely skoršie skaly. Podstatou týchto inštalácií je os chomu.
- KIM na základe revízie systému a vedomostí, ako vidieť, ako inovatívne jadro meniace sa programy chémie pre vzdelávacie organizácie. Štandardný systém vedomostí je prezentovaný ako vimogi pred prípravou absolventov. S pomocou vimogov musíte namiesto konverzie prispôsobiť prezentáciu v prvkoch KIM.
- S cieľom zabezpečiť možnosť diferencovaného hodnotenia vedúcich pracovníkov KIM ЄDI by sme mali prehodnotiť vývoj základných vzdelávacích programov z chémie na tri stupne skladania: základný, špecifický Navchalny material, základom, pre ktorý sa bude učiteľ vzdelávať, je hľadanie vedomostí o jeho význame pre výchovno-vzdelávaciu prípravu absolventov stredných škôl.
- Zriadenie náhradného robotického transferu Medzi nimi sú najpôsobivejšie є, napríklad taký, yak: prejavy klasifikácií slov a reakcií; začiatkom oxidačných krokov chemické prvky za vzorcami їх spolok; Vysvetlite podstatu tohto procesu, prepojenie skladu, budovi, že silu reči. Podľa skúmaného zdravého vývoja je víťazný robot indikátorom získaného materiálu s potrebnou inteligenciou.
- Ekvivalentnosť všetkých možností náhradných robotov sa nebude brať do úvahy pri rovnakej rýchlosti zmeny závodu, takže budú nanovo upravovať základné prvky pre zmenu kľúčových sadzieb.
4. Štruktúra KIM DI
Možnosť skinu na preskúmanie motivácie robota za rovnakým plánom: robot je uložený v dvoch častiach, ktoré zahŕňajú 40 budov. 1. časť odhaľuje 35 budov s krátkym pohľadom, v strede je 26 budov základnej rozkladacej úrovne (poradie čísiel budov: 1, 2, 3, 4, ... 26) a 9 diel tzv. upravená úroveň skladania (čísla čísiel budov, 29: 27, 28 , ... 35).
2. časť odhaľuje 5. budovu najvyššej úrovne rozkladu s uzavretým otvorom (poradové čísla budov: 36, 37, 38, 39, 40).
Typy testov a testov z chémie Existuje 10 možností pre súbory budov, ktoré sú uložené pomocou najdôležitejších vlastností a vo forme jediného suverénneho zdravotného poistenia v roku 2017. Zmyslom knihy je poskytnúť čitateľom informácie o štruktúre a štruktúre zimného KIM 2017 z chémie, o krokoch skladania budov.
Obchod poskytol súhrn všetkých možností testovania a je uvedené rozhodnutie všetkých prevádzok o jednej z možností. Okrem toho sme poukázali na formy, ako napríklad vikoristoyuyutsya na ЄDI, na zaznamenávanie názorov a rozhodnutí.
Autorom projektu je provinčný naukovets, vikladach, ktorý metodológ, ktorý sa stará o osud za hranicou vývoja kontroly životne dôležitých materiálov DI.
Indikačná kniha pre učiteľov na prípravu vedcov pred odchodom do školy z chémie, ako aj pre starších vedcov a absolventov - na sebaprípravu a sebakontrolu.
dať to na.
Chlorid amónny obsahuje chemické zlúčeniny:
1) іонні
2) kovalentná polarita
3) kovalentné nepolárne
4) voda
5) kov
Od navrhovateľa prepisu reči, aby sa zabalili dve slová, z ktorých sú citlivé.
1) chlorid zinočnatý (roztok)
2) síran sodný (roztok)
3) zriedená kyselina dusičná
4) koncentrovaná kyselina sirchanová
5) oxid hlinitý
ЗМІСТ
Peredmová
Pokyny pre robotiku
VARIANT 1
Časť 1
Časť 2
VARIANT 2
Časť 1
Časť 2
VARIANT 3
Časť 1
Časť 2
VARIANT 4
Časť 1
Časť 2
VARIANT 5
Časť 1
Časť 2
VARIANT 6
Časť 1
Časť 2
VARIANT 7
Časť 1
Časť 2
VARIANT 8
Časť 1
Časť 2
VARIANT 9
Časť 1
Časť 2
VARIANT 10
Časť 1
Časť 2
VIDPOVIDI TA RISHENNYA
Pohľad na budovu 1. časti
Rozhodnutie a revízia stavby 2. časti
Možnosť Rozv'yazannya zavdan 10
Časť 1
Časť 2.
Kot-free doplnok e-kniha v manuálnom formáte, div, že znie:
Stiahnite si knihu ADI 2017, Chémia, Typovi testyі zavdannya, Medvedev Yu.M. -fileskachat.com
- ЄDI 2020, Khimia, Typy možností pre náhradné závody z vývoja DI, Medvedev Y.M., 2020
- ЄDI 2019, Khimiya, expert na ЄDI, Medvedev Yu.M., Antoshin A.E., Ryabov M.A.
- ODE 2019, Chimiya. 32 možností, Typy testov, ktoré prevádzkujú ODE rozrobniki, Molchanova G.M., Medvedev Yu.M., Koroshenko O.S., 2019
- Khimiya, United State Inspection, Gotuumos pred atestáciou, Kaverina A.A., Medvedev Yu.M., Molchanova G.M., Sviridenkova N.V., Snastina M.G., Stakhanova S.V., 2019
Pre vikonannya zavdan 1-3 vikoristovyte útočný rad chemických prvkov. Uvidím to v rastlinách 1-3 túto sériu.
1) Na 2) K 3) Si 4) Mg 5) C
Zavdannya číslo 1
Mimochodom, atómy niektorých významov pre množstvo prvkov môžu byť na novom energický chotiri elektroni.
Zobrazenie: 3; 5
Počet elektrónov na hornom napájacom prvku (elektronická guľa) hlavných skupín v čísle dverí skupiny.
V takomto rangu z daných možností pre typy nápadov prejsť na kremík a uhlie, pretože smrad zaplaví hlavovú skupinu štvrtej skupiny stolov D.I. Mendeleva (skupina IVA), tobto. vіrnі vіdpovіdі 3 a 5.
Zavdannya číslo 2
Z významov pre množstvo chemických prvkov existujú tri prvky, ako pre periodické systémy chemických prvkov D.I. Mendeleva perebuyut v jednom období. Otočte prvky vibrani v poradí rastu kovových síl.
Do poľa zapíšte počet vibrujúcich prvkov v poli podľa potreby.
Zobrazenie: 3; 4; jeden
Tri zastúpenia prvkov v jednom období є tri - sodík Na, kremík Si a horčík Mg.
V prípade rus na hraniciach obdobia Periodické tabuľky D.I. Mendeleva (horizontálne rady), pravák si ľahne na dodávku elektrónov, roztasvanih volacích loptičiek, tobto. splniť kovovú silu živlov. V takom rade je možné použiť kovovú silu sodíka, kremíka a horčíka v rade Si Zavdannya č. 3 Okrem hodnôt niekoľkých prvkov vibrujú dva prvky, ktoré sú nižším stupňom oxidácie, rovné -4. Zapíšte si počet vibrujúcich prvkov v poli. Zobrazenie: 3; 5 Podľa pravidla oktetu atómy chemických prvkov tlačia matky do ich vlastných elektronických zariadení 8 elektrónov, ako v vzácnych plynoch. Zo zvyšku ryvny je možné dosiahnuť celkový počet elektronických zariadení, aj keď počet elektronických zariadení je do osem. Natrii a cali sú prenášané na cudzie kovy a nachádzajú sa v hlavnej skupine prvej skupiny (IA). Tse znamená, že jedna elektronická guľa sa používa naraz pre jedno elektronické zariadenie. Pri spojení s cym je energeticky živý ako strata jedného elektrónu, pod sedem. Veľkosť situácie je analogická, len je v čele skupiny inej skupiny, takže na novej sú dva elektróny. Slide znamená, že sodík, vápnik a horčík sú umiestnené pred kovmi a kovy v zásade nemusia mať negatívny oxidačný krok. Minimálna úroveň oxidácie, či už je kov drahý, je nula, čo je bežnejšie povedané jednoduchými slovami. Chemické prvky v uhlíku C a kremíku Si sú nekovy a nachádzajú sa v hlavnej skupine štvrtej skupiny (IVA). Tse znamená, že na prvej elektronickej guličke sú 4 elektróny. Navyše pre množstvo prvkov je možné poskytnúť množstvo elektrónov, takže je možné dodať aj toľko peňazí, čo je drahé na 8 minút. Je možné použiť viac ako 4 elektróny kremíka a uhlíka, takže minimálny oxidačný krok sú 4. Zavdannya č. 4 Z proponovaného striedania rozvibrujte dve polovice, v ktorých majú veselý zvuk. Zobrazenie: 1; 3 Je možné, že prítomnosť iónového typu spojenia v pozadí pri prechode na veľký počet typov je možná, pretože atómy typického kovu a atómy nekovu môžu vstúpiť do štruktúrnych jednotiek naraz. Pre pár známych zistím, že iónový kruh є v druhom čísle 1 je Ca (ClO 2) 2, pretože V tomto vzorci je možné pridať atómy typického kovu ku vápniku a atómy nekovov ku kyseline a chlóru. Je však lepšie pomstiť sa atómom kovu a nekovu naraz, neexistuje žiadny náznak vyššie uvedeného zoznamu. Okrem toho existujú náznaky, že prítomnosť iónovej väzby v prvom rade možno povedať, že v sklade tejto štruktúrnej jednotky je amónny katión (NH 4 +) alebo organické analógy - alkilamóniové katióny + RNHyalkylové katióny 3 N + і tetraalkylamónium R4N+, de R je sacharidový radikál. Napríklad iónový typ väzby je nízky v prítomnosti (CH3)4NCl a katiónu (CH3)4+ a chloridového iónu Cl-. Medzi významy rastliny patrí chlorid amónny, nová iónová väzba sa realizuje medzi amónnym katiónom NH 4 + a chloridovým iónom Cl -. Zavdannya č. 5 Stanovte podobnosť medzi rečovým vzorcom a triedou / skupinou, ku ktorej by sa mala (-tá) reč zaviesť: do polohy kože, označenej písmenom, zaujmite danú polohu z ostatných sto, polohy. Zapíšte si do poľa počet vibračných údajov. Pohľad: А-4; B-1; U 3 vysvetlenie: Kyslé soli sa nazývajú soli, ktoré sa vyvinuli ako výsledok nekajúcnej substitúcie základných atómov za kovové katióny, amónne katióny alebo alkilamíny. Anorganické kyseliny, ktoré prechádzajú v rámci školských programov, sú všetky atómy drobivé, takže by ich mal nahradiť kov. Prídavok solí anorganických kyselín v strede prezentovaného zoznamu je hydrouhličitan amónny NH 4 HCO 3 - produkt substitúcie jedného z dvoch atómov vo vode z kyseliny uhličitej za amónny katión. V deň kyslé sіl - je priemerná mіzh normálna (stredná) sіll a sіll a kyslá. V prípade NH 4 HCO 3 je to stredná polovica normálneho oleja (NH 4) 2 CO 3 a kyseliny uhličitej H 2 CO 3. V organickej reči sú atómy kovov nahradené iba atómami vody, ktoré môžu byť zahrnuté do zásoby karboxylových skupín (-OOH) alebo hydroxylových skupín fenolov (Ar-OH). Takže napríklad octan sodný CH 3 COONa nie je ovplyvnený tými, v ktorých nie všetky atómy v molekule sú nahradené katiónom kovu, є stredným, a nie kyslým bahnom (!). Atómy v organickej reči, pripojené bez stredu k atómu v uhlíku, sa prakticky nemenia na atómový kov, za vinu atómov vo vode s náročným zvukom. Nesotvorné oxidy - oxidy nekovov, ktoré sú so zásaditými oxidmi a zásadami solí nastavené tak, že kvôli tomu nereagujú (najčastejšie), pretože reakcia s ním má menší produkt. (nie sily). Často sa zdá, že nerozpustné oxidy sú oxidy nekovov, ktoré nereagujú so zásadami a zásaditými oxidmi. Chrániť, vzhľad nesoľnotvorných oxidov, ako je spratsovuyu zvzhd. Napríklad CO, ktorý je nesoliacim oxidom, reaguje so zásaditým oxidom Zaliz (II), čo nie je soľ, ale normálny kov: CO + FeO = C02 + Fe K neslaným oxidom zo školského kurzu chémie sa oxidy nekovov prenášajú v oxidačnom stupni +1 a +2. Je to ľahké vidieť v ЄDI 4 - CO, NO, N 2 O a SiO (zvyšok SiO nie je v rastlinách veľmi bežný). Zavdannya číslo 6 Z navrhovateľského prepisu reči zabaľte dve reči, z kože jazyka reaguje bez zahrievania. Zobrazenie: 2; 4 Chlorid zinočnatý sa premieňa na soli a chlorid zinočnatý na kovy. Kov reaguje len zo soli, rovnako, keďže je aktívnejší počas dňa, je možné vstúpiť do skladu soli. Je evidentné, že aktivita kovov je evidentná vďaka nízkej aktivite kovov (podľa množstva pružín kovov). Zalizo v rade aktivity kovu je to pravé pre zinok, ale aj menej aktívny a nie zdravý zinok zo soli. Takže reakcia na správu z prejavu č. 1 sa nenašla. Sulfát mіdі (II) CuSO 4 bude reaktívny so zalizom, keďže sa s najväčšou pravdepodobnosťou nachádza v rozsahu aktivity, takže ide o aktívnejší kov. Dusík je koncentrovaný a tiež koncentrovaný v kyseline a nehromadí sa bez zahrievania reakcie so zinkom, hliníkom a chrómom v prítomnosti takéhoto prejavu, ako je pasivácia: na povrchu týchto kovov zohráva úlohu zrážania kyselín sa nevyskytuje. Proteín, keď sa zahrieva, spálená škrupina sa vyvíja a reakcia sa stáva náladovou. Tobto. oskіlki je indikovane, tak zahrejem, reakcia zaliza z konc. HNO 3 nie je proti. Kyselina chlorovodíková sa môže redukovať na neoxidačné kyseliny bez ohľadu na koncentráciu. S kyselinami, neoxidačnými činidlami, reagujú s vodou, ale stoja pri mnohých činnostiach viac ako voda. K takýmto kovom vyložiť zalizo. Višňovok: reakcia soli s kyselinou chlorovodíkovou. V prípade reakcií kovu a oxidu kovu, ako aj pri páde kovu je možné, že aktívny kov je aktívny pre tie, ktoré vstupujú oxidom do skladu. Fe, v blízkosti množstva kovových aktivít, menej aktívne, menej Al. Tse znamená, že Fe nereaguje s Al 2 O 3. Zavdannya číslo 7 Obaľte dva oxidy z proponovaného transferu, ktoré reagujú s roztokom kyseliny chlorovodíkovej, ale nereagujte
z radu hydroxidu sodného. Zapíšte si do poľa počet vibrujúcich slov. Zobrazenie: 3; 4 CO je neslaný oxid, s vodou na lúke nereagujem. (Slide pam'yatati, shho, tim nie mensh, v tvrdých mysliach - silný zlozvyk a teplota - víno stále reaguje s pevnou lúkou, je schválený formiati - soli kyseliny murashinoy.) SO 3 - oxid sírový (VI) je kyslý oxid, čo je druh kyseliny sírovej. Nereagujte s kyslými oxidmi a inými kyslými oxidmi. Tobto SO 3 nereaguje s kyselinou chlorovodíkovou, ale reaguje so zásadou - hydroxidom sodným. Nechoďte. CuO - oxid midi (II) - sa vykonáva na oxidy s rôznymi hlavnými silami. Reaguje s HCl a nereaguje s hydroxidom sodným. Choď MgO - oxid horečnatý - sa mení na typické zásadité oxidy. Reaguje s HCl a nereaguje s hydroxidom sodným. Choď ZnO je oxid so silnými amfotérnymi schopnosťami - ľahko vstupuje do reakcie so silnými zásadami aj kyselinami (ako aj kyslými a zásaditými oxidmi). Nechoďte. Zavdannya číslo 8 Zobrazenie: 4; 2 Pri reakcii s dvoma soľami anorganických kyselín sa plyn odstaví, ak dôjde k zmene rozkladu dusitanov za tepla a amónnych solí v dôsledku tuhnutia tepelne nestabilného dusitanu amónneho. Napríklad, NH4CI + KNO2 = to => N2 + 2H20 + KCl Zoznam však neobsahuje dusitany a amónne soli. Dokonca jedna z troch solí (Cu (NO 3) 2, K 2 SO 3 і Na 2 SiO 3) reaguje buď s kyselinou (HCl) alebo s vodou (NaOH). Spomedzi solí anorganických kyselín vidia plyn počas interakcie z lúk iba amónne soli: NH4+ + OH = NH3 + H20 Soľný amoniak, ako povedali, zoznam je hlúpy. Aby ste boli zahltení možnosťami interakcie soli s kyselinou. Cu (NO 3) 2, K 2 SO 3 і Na 2 SiO 3 by mali byť v strede riek prekryté soľami. neuspokojiť sa s plynom, ani obliehaním, ani trochou disociovanej reči (voda alebo slabá kyselina). Silikat sodný reaguje s kyselinou chlorovodíkovou, chráni pohľad na biele dražé obliehanie kyseliny kremičitej, a nie plyn: Na2Si03 + 2HCl = 2NaCl + H2Si03 ↓ Zostávajúcou možnosťou je výmena síranu vápenatého a kyseliny chlorovodíkovej. V dôsledku reakcie iónovej výmeny so siričitanom je určite praktické, či sa ako kyselina použije nealkoholická kyselina, pretože sa zmiernilo, že spadne na bezplynový oxid sivej (IV) a vodu. Zavdannya číslo 9 Z písmen zapíšte počty vibračných prejavov do tabuľky. Zobrazenie: 2; 5 CO 2 sa prenáša na kyslé oxidy a potom na jeho premenu na olej je potrebné použiť buď zásaditý oxid, alebo zásadu. Tobto. Uhličitan vápenatý treba orezať CO 2, ale je potrebné vložiť buď oxid vápenatý alebo hydroxid vápenatý. V takom poradí je reč X oxid vápenatý: K20 + C02 = K2C03 Hydrogénuhličitan vápenatý KHCO 3, čo je uhličitan vápenatý, kyselina síranová, s rovnakou redukciou, ale hydrouhličitan є je produktom neúplnej substitúcie atómov vo vode z prchavých kyselín. Kyslé je potrebné orezať normálnou (strednou) soľou, treba to brať s touto kyselinou, ktorá je schválená kyselinou, alebo ako kyslý oxid, ktorý je daný kyselinou, za prítomnosti vody. Činidlo Y є je teda kyselina uhličitá. Keď prechádza cez vodnú medzeru, kalórie zostávajú v kalóriách uhľovodíkov: K2C03 + H20 + C02 = 2KHC03 Zavdannya číslo 10 Stanovte vzťah medzi relatívnymi reakciami a silou prvku na dusík, ako výsledok tejto reakcie: pred polohou kože, označenou písmenom, zaujmite danú polohu, polohu. Z písmen zapíšte počty vibračných prejavov do tabuľky. Pohľad: А-4; B-2; IN 2; G-1 A) NH 4 HCO 3 - sil, pred sklad zaradiť amónny katión NH 4 +. V amónnych katiónoch je dusík zvyčajne oxidovaný, ale drahý -3. V dôsledku reakcie sa víno premení na amónny NH3. Voda je prakticky závislá (na druhej strane pri kovoch) oxidačné stupne sú dostatočne vysoké na cestu +1. Navyše, amónna molekula je elektricky neutrálna, dusík je zodpovedný za matku oxidačných krokov, čo je drahé -3. Otzhe, zmeniť štádium oxidovaného dusíka nie je, tobto. vyhrať nie viyavlya oxid-vіdnovnyh moc. B) Yak bulo je zobrazený v potravinách, dusík v amoniaku NH 3, oxidované kroky -3. V dôsledku reakcie s CuO sa amiak premení na jednoduchú reč N2. Ak ide o jednoduchú reč, kroky oxidovaného prvku, ktoré boli schválené, budú nulové. Atóm dusíka teda spotrebúva svoj vlastný záporný náboj a fragmenty záporného náboja indukujú elektroniku, čo znamená, že atóm dusíka je v dôsledku reakcie absorbovaný. Prvok, ktorý v dôsledku reakcie spotrebuje časť svojich elektrónov, sa nazýva olovo. C) V dôsledku reakcie NH3 so stupňom oxidovaného dusíka, ktorý je drahý -3, sa premení na oxid dusíka NO. Kisen je prakticky závislý od oxidačných krokov, ktoré sú drahé -2. Za týmto účelom je molekula oxidu dusíka elektricky neutrálna, atóm dusíka je zodpovedný za oxidačné kroky +2. To znamená, že atóm dusíka sa počas reakcie mení v oxidačných krokoch z -3 na +2. Tse hovorí o strate 5 elektrónov atómom dusíka. Tobto dusík, ako і trample B, є protagonista. D) N 2 - jednoduchá reč. Všetky jednoduché frázy majú prvok, ako je oxidačný krok, ktorý je 0. V dôsledku reakcie sa dusík premení na nitrid lítny Li3N. Jednotlivé kroky oxidovaného kovu, okraj nula (kroky oxidácie 0, pre akýkoľvek prvok), dvere +1. Štrukturálna jednotka Li3N je teda elektricky neutrálna, dusík je zodpovedný za matku oxidovaných krokov, ktorá je -3. V dôsledku reakcie dusík naplnil záporný náboj, čo znamená dodávku elektrónov. Dusík pri oxidačnej reakcii tsy. Zavdannya číslo 11 Vytvorte vzťah medzi rečovým vzorcom a reagenciami s pokožkou, z ktorej môže byť reč prepojená: k polohe kože označenej písmenom, zvážte typ polohy označenej číslom. D) ZnBr2 (roztok) 1) AgN03, Na3P04, Cl2 2) BaO, H20, KOH 3) H2, Cl2, O2 4) HBr, LiOH, CH3COOH 5) H3P04, BaCl2, CuO Z písmen zapíšte počty vibračných prejavov do tabuľky. Pohľad: А-3; B-2; AT 4; G-1 A) Keď voda podobná plynu prechádza cez taveninu vody, voda H 2 S sa nastaví: H2 + S = to => H2S Keď chlór prechádza cez jemnú vodu pri izbovej teplote, vodný dichlorid sa nastaví: S + Cl2 = SCI2 Pre zdachi ЄDI vrchnosť určite ako reagovať s chlórom a zapisovať cenu netreba. Golovne - na princípe rovnakého pam'yatati, ale syrka s chlórom reaguje. Chlór je silné oxidačné činidlo a sirka je často podriadená svojej funkcii - bude oxidovať, takže bude rovnako účinná. Tobto, ak sa vloží do šedej so silným oxidačným činidlom, ako je molekulárny chlór Cl 2, zoxiduje. Klesať na horenie v modrej polovici pri kyslom plyne so štipľavým zápachom - oxid siričitý SO 2: B) SO 3 - oxid sirka (VI) so silnou kyslosťou. Pre takéto oxidy sú najcharakteristickejšie reakcie interakcie s vodou, ako aj so zásaditými a amfotérnymi oxidmi a hydroxidmi. Zoznam č. 2 obsahuje bacimo a vodu, zásaditý oxid BaO a hydroxid KOH. Keď kyslý oxid interaguje so zásaditým oxidom, vytvorí sa silná kyselina a kov sa pridá k zásaditému oxidu. Oxid kyseliny Yakou tvorí kyselinu, v ktorej sa prvok rozpúšťajúci kyselinu nachádza v rovnakých štádiách oxidácie, ale aj v oxide. Oxid SO 3 je formulácia kyseliny sírovej H 2 SO 4 (tam a tam sú stupne oxidácie vody +6). Pri interakcii SO 3 s oxidmi kovov teda vzniknú soli kyseliny chlorovodíkovej - síran, ktoré nahradia síranový ión SO 4 2-: SO3 + BaO = BaSO4 Pri interakcii s vodou sa kyslý oxid premení na druh kyseliny: S03 + H20 = H2S04 A pri súhre kyslých oxidov s hydroxidmi kovov vzniká silná kyselina a voda: S03 + 2KOH = K2S04 + H20 C) Hydroxid zinočnatý Zn (OH) 2 je typ amfotérnej sily, ktorá reaguje s kyslými oxidmi a kyselinami, ako aj so zásaditými oxidmi a lúkami. V zozname sú 4 kyseliny bacimo yak - brómová voda HBr і і і lug - LiOH. Nagadaєmo, ktoré sa nazýva lúky vo vode hydroxidov kovov: Zn(OH)2 + 2HBr = ZnBr2 + 2H20 Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H20 Zn(OH)2 + 2LiOH = Li2 D) Bromid zinočnatý ZnBr 2 є сіlu, razchinniy vo vode. Pre maloobchodné soli je najširšou možnou reakciou iónová výmena. Môžete reagovať so svojím dieťaťom rozumne, keď vás urazí zlomyseľné soli a keď dôjde k obliehaniu. ZnBr2 môže byť tiež nahradený bromidovým iónom Br-. Pre halogény kovov je charakteristické, že zapáchajú ako reakcia s halogénmi Hal 2, ktoré možno nájsť v Mendelovej tabuľke. Podľa tejto hodnosti? popísané typy reakcií idú proti zoznamu 1: ZnBr2 + 2AgN03 = 2AgBr + Zn (N03)2 3ZnBr2 + 2Na3PO4 = Zn3(P04)2 + 6NaBr ZnBr2 + Cl2 = ZnCl2 + Br2 Zavdannya číslo 12 Určte typ prejavu podľa názvu prejavu a triedy / skupiny, do ktorej (-tej) má byť reč: k polohe kože označenej písmenom, vyberte typ polohy označenej číslom. Z písmen zapíšte počty vibračných prejavov do tabuľky. Pohľad: А-4; B-2; V 1 vysvetlenie: A) Metylbenzén v rovnakom toluéne, základný štruktúrny vzorec: Yak môže byť baciti, molekuly tejto reči sú uložené len v uhlíku a vode, preto sa k sacharidom pridáva metylbenzén (toluén). B) Štruktúrny vzorec pre anilín (aminobenzén) je nasledujúci: Yak môže byť založený na štruktúrnom vzorci, molekula anilínu je uložená v aromatickom uhľohydrátovom radikále (C 6 H 5 -) a aminoskupine (-NH 2), v takom poradí, anilín je prenesený na aromatické amíny, tobto. správny pohľad 2. C) 3-metylbutanal. Dokončenie "al" hovoriť o tých, ale reč sa nesie pred aldehydy. Štrukturálny vzorec reči: Zavdannya č. 13 Z navrhovanej verzie zabaľte dve slová, napríklad štruktúrne izoméry 1-buténu. Zapíšte si do poľa počet vibrujúcich slov. Zobrazenie: 2; 5 vysvetlenie: Izoméry sú slová, ktoré majú rovnaký molekulový vzorec a štrukturálne odlišné. Reč, ktorá je založená na poradí polovičných atómov, pochádza zo samotného skladu molekúl. Zavdannya číslo 14 Od zástancu prechodu na zabalenie dvoch prejavov, s interakciou manganistanu s kalibrom, dochádza k zmene v rozložení kalibru. Zapíšte si do poľa počet vibrujúcich slov. Zobrazenie: 3; 5 vysvetlenie: Alkány, ako aj cykloalkány s malým cyklom s 5 a viac atómami uhlíka, sú inertné a nereagujú s vodnými roztokmi za vzniku silných oxidantov, ako sú napríklad manganistan draselný KMnO 4 a dvojchróman vápenatý K 2 Cr 2 O 7 . V takomto poradí prichádzajú do úvahy možnosti 1 a 4 - keď sa do hladiny vody pridá cyklohexán alebo propán, množstvo manganistanu sa neuloží. Medium v uhľohydrátoch homologické s radom benzén je pasívne až do vodnej hladiny oxiduje iba benzén, sitové homológy sa oxidujú v nánosoch od stredného rozsahu buď na karboxylové kyseliny, alebo tvoria soli. V takomto rangu verzia 2 (benzén). Správne typy sú 3 (toluén) a 5 (propylén). Urážaný rečou, nie je možné vziať farbu manganistanu cez prebytok reakcií: CH3-CH = CH2 + 2KMnO4 + 2H20 → CH3-CH (OH)-CH2OH + 2Mn02 + 2KOH Zavdannya číslo 15 Z navrhovanej verzie zabaľte dva prejavy, pričom formaldehyd reaguje. Zapíšte si do poľa počet vibrujúcich slov. Zobrazenie: 3; 4 vysvetlenie: Formaldehyd patrí do triedy aldehydov - pneumatických organických spoluok, čo môže byť aldehydová skupina na konci molekuly: Typické reakcie aldehydov sú reakcie oxidácie a obnovy, ktoré prebiehajú pozdĺž funkčnej skupiny. Uprostred zmeny indikácie formaldehydu je charakteristická reakcia obnovy, ako hlavný dôvod, voda (kat. - Pt, Pd, Ni) a oxidácia - pri reakcii sekundárneho zrkadla. Pri aktualizácii na niklovom katalyzátore sa formaldehyd premení na metanol: Reakcia zrkadla média je reťazec reakcie obnovy média do oblasti média oxidu amónneho. V prípade vodného roztoku z amoniaku sa oxid média premení na komplexný roztok - hydroxid diaminstrieborný (I) OH. Na pridanie formaldehydu do oxidačne vedúcej reakcie, do ktorej sa zavádza: Zavdannya č. 16 Z navrhovanej verzie zabaľte dve slová, s ktorými metylamíny reagujú. Zapíšte si do poľa počet vibrujúcich slov. Zobrazenie: 2; 5 vysvetlenie: Metylamín je najjednoduchší typ organickej triedy aminov. Charakteristickou črtou amínov je prejav absencie elektronických stávok na atómy dusíka, okrem toho sa zdá, že aminity sú v moci základov a reakcií v úlohe nukleofilov. V takomto poradí spojenie s cyme z proponovaných verzií typov metylamínu ako báza a nukleofil reagujú s chlórmetánom a kyselinou chlorovodíkovou: CH3NH2 + CH3CI → (CH3)2NH2 + Cl - CH3NH2 + HCl → CH3NH3 + Cl - Zavdannya číslo 17 Na prepracovanie prejavov je nastavená nasledujúca schéma: Po prvé, zo zmysluplných prejavov є prejavov X a Y. Z písmen zapíšte počty vibračných prejavov do tabuľky. Zobrazenie: 4; 2 vysvetlenie: Jednou z reakcií alkoholov je reakcia na hydrolýzu halogénovaných alkánov. Z chlóretánu je teda možné odstrániť etanol tak, že pôjdete na poslednú vodnú lúku – v tomto type NaOH. CH3CH2CI + NaOH (aq) → CH3CH2OH + NaCl Útočná reakcia є oxidačná reakcia etylalkohol... Oxidované alkoholy sa môžu použiť na strednom katalyzátore, napríklad pre víťazstvá CuO: Zavdannya číslo 18 Určte typ reči podľa názvu produktu, ktorý je dôležitý pre interakciu reči s brómom: do polohy kože, označenej písmenom, vezmite do úvahy danú polohu, číslom. Zobrazenie: 5; 2; 3; 6 vysvetlenie: Pre alkány sú najcharakteristickejšími reakciami reakcia radikálovej substitúcie, pri ktorej je atóm nahradený atómom halogénu. V takom poradí sa pri brómovaní etánom môže stripovať brómmetán a pri brómovaní izobutánom - 2-brómizobután: Fragmenty malých cyklov molekúl cyklopropánu a cyklobutánu sú nestabilné, keď sa brómované cykly molekúl otvárajú v takom rozsahu proti reakcii prijatia: Na základe cyklu cyklopropánu a cyklobutánu má cyklus cyklohexánu veľkú veľkosť, v tomto prípade sa uvažuje o náhrade atómu atómom vodíka za atóm brómu: Zavdannya č. 19 Stanovte typ reči medzi reagujúcimi slovami a produktom, ktorý sa pomstí za uhlie, ktorý je stanovený interakciou týchto slov: pred polohou kože, označenou písmenom, pozri číslo, pozíciu Z písmen zapíšte číslice vibránia do tabuliek. Zobrazenie: 5; 4; 6; 2 Zavdannya č. 20 Z proponovanej výmeny typov reakcií existujú dva typy reakcií, až po interakciu s vodou. Napíšte počet typov vibrácií v teréne. Zobrazenie: 3; 4 Pudlové kovy (Li, Na, K, Rb, Cs, Fr) sa roztasovali v čele I. skupiny tabuľky D.I. Mendeleva sú predkovia, je ľahké vydať elektronické zariadenie a môžu sa nosiť na meno rodiny. Ak označíme kalužový kov písmenom M, potom reakcia kalužového kovu s vodou vyzerá takto: 2M + 2H20 -> 2MOH + H2 Ešte aktívnejšie hádzali mláky na ceste k vode. Reakcie na obrázky skvelé číslo teplo, є nebráno a nie vimage katalyzátora (nekatalytický) - reč, ktorá urýchľuje reakciu tak, že sa nedostane do skladu produktov reakcie. Posuňte to znamená, že všetky exotermické reakcie sa nevymknú kontrole katalyzátora a neprejdú. Oskіlki kov a voda - prejavy, ale v malých mlynoch na agregáty je celá reakcia proti medzifázovým fázam dokonca heterogénna. Typ reakčného cyklu je substitúcia. Reakcie z neorganických rečí sa dostávajú do reakcií suplovania, ako v prípade jednoduchej reči, pretože je skladacia a v dôsledku toho vznikajú jednoduché a skladacie reči. (Neutralizačná reakcia proti kyseline a zásade, v dôsledku ktorej dochádza k výmene reči s jej pamäťovými časťami a ktorá je založená na malej disociácii reči). Yak bulo povedal vishche, kaluže hádzali predkovia, dávali elektrón zo zvoniacej gule a reakcia bola oxidovaná. Zavdannya číslo 21 Z proponovanej premeny nových nástrekov zabaľte dva nástreky, ktoré povedú k zmene účinnosti reakcie etylénu z vody. Do poľa si zapíšte počet vibračných hovorov. Zobrazenie: 1; 4 na rýchlosti chemické reakcie vstrekujú nasledujúce faktory: zmena teploty a koncentrácie činidiel, ako aj viktoriánsky katalyzátor. Podľa empirického pravidla Van't Hoffa, keď je teplota na koži 10 stupňov, konštanta plynulosti homogénnej reakcie sa zvyšuje 2-4 krát. Zníženie teploty tiež povedie k zníženiu rýchlosti reakcie. Prvá možnosť je prísť. V skutočnosti, likvidita vstreknutej reakcie a zmena koncentrácie činidiel: ak sa koncentrácia etylénu zvýši, potom rast a rýchlosť reakcie nie sú z výroby zrejmé. A zmena koncentrácie vody - špecifickej zložky, navpaki, znižuje rýchlosť reakcie. Otzhe, iná možnosť nie je ísť, ale štvrť - ísť. Katalyzátor je reč, ktorá urýchli rýchlosť chemickej reakcie, ale nevstúpi do skladu produktov. Víťazný katalyzátor urýchlil prekročenie reakcie hydratácie na Etilene, ale mysle manažéra to tiež nepovažovali za správne. Pri prepojení etylénu s vodou (na katalyzátoroch Ni, Pd, Pt) vzniká etán: CH2 = CH2 (g) + H2 (g) → CH3-CH3 (g) Zložky, ktoré sú v reakcii, aj produkt sú plynové rečové čiary a tlak systému sa tiež podieľa na rýchlosti reakcie. Z dvoch obsyag_v na etilen a vodnyu schváliť jeden obsyag na ethanu, otzhe, reakciu alebo zmeniť uchytenie systému. Pivshchivshi zverák mi rýchla reakcia. nechoďme. Zavdannya číslo 22 Stanovte špecifickosť medzi zložením soli a produktmi elektrolýzy rozsahu vody celej soli, ktorá bola viditeľná na vnútorných elektródach: do polohy kože, Soľný vzorec VÝROBKY ELEKTROLIZU Z písmen zapíšte číslice vibránia do tabuliek. Zobrazenie: 1; 4; 3; 2 Elektrolýza je oxidačno-sekundárny proces, ktorý prebieha na elektródach, keď postelektrický brnkák prechádza cez rozchin alebo elektrolytickú taveninu. Na katóde je dôležité obnoviť tiché katódy, ktoré môžu byť najaktívnejšie. Na anóde sú v prvom rade tie anóny oxidované, čo môže byť najbežnejšia stavba. Elektrolýza vody 1) Proces elektrolýzy rozpadu vody na katóde nespočíva v materiáli katódy, ale skôr v polohe kovového katiónu v elektrochemickom rade. Pre katióny vedľa Procesy obnovy Li + - Al 3+: 2H20 + 2e → H2 + 2OH - (H2 je vidieť na katóde) Proces aktualizácie Zn 2+ - Pb 2+: Me n + + ne → Me 0 a 2H20 + 2e → H2 + 2OH - (H2 a Me sú viditeľné na katóde) Proces obnovy Cu 2+ - Au 3+ Me n + + ne → Me 0 (Me je vidieť na katóde) 2) Proces elektrolýzy rozpadov vody na anóde je deponovaný z materiálu anódy a z povahy anódy. Yaksho anóda nie je pozoruhodná, tobto. Inertné (platina, zlato, vugilla, grafit), potom je menej pravdepodobné, že sa tento proces vyskytne z prírody. Pre anióny F -, SO 4 2-, NO 3 -, PO 4 3-, OH - oxidačný proces: 4OH - - 4e → O 2 + 2H 2 O alebo 2H 2 O - 4e → O 2 + 4H + (na anóde je viditeľná kyselina) halogén-iónový (crim F-) oxidačný proces 2Hal - - 2e → Hal 2 (viditeľný halogén ) oxidačný proces organických kyselín: 2RCOO - - 2e → R-R + 2CO 2 Sumarne Rivnyannya Elektrolizu: A) rozsah Na3PO4 2H20 → 2H2 (na katóde) + O2 (na anóde) B) rozsah KCl 2KCl + 2H20 → H2 (na katóde) + 2KOH + Cl2 (na anóde) C) rozsah CuBr2 CuBr 2 → Cu (na katóde) + Br 2 (na anóde) D) rozsah Cu (NO3) 2 2Cu (NO 3) 2 + 2H 2 O → 2Cu (na katóde) + 4HNO 3 + O 2 (na anóde) Zavdannya číslo 23 Stanovte vzťah medzi názvom soli a súborom soli k hydrolýze: do polohy pokožky, označenej písmenom, zaujmite danú polohu označenú číslom. Z písmen zapíšte číslice vibránia do tabuliek. Zobrazenie: 1; 3; 2; 4 Hydrolýza solí je interakcia solí s vodou, ktorá vedie k adícii katiónu s vodou H + k molekule olova na anión prebytku kyseliny a (alebo) hydroxylovej skupiny OH - molekuly olova ku katiónu kovu. . Hydrolýza je produkovaná soľami vytvorenými s katiónmi, ktoré svedčia o slabých zásadách, a aniónmi, ktoré poukazujú na slabé kyseliny. A) Chlorid amónny (NH 4 Cl) - sil, fixovaný silnou kyselinou chlorovodíkovou a amóniom (slabá zásada), ktorý sa má hydrolyzovať katiónom. NH4Cl → NH4+ + Cl - NH 4 + + H 2 O → NH 3 · H 2 O + H + (schválené vodou amiaku) Olejnatá je kyslá (pH< 7). B) Síran vápenatý (K 2 SO 4) - silná, silná kyslá kyselina a hydroxid vápenatý (lúka, teda silná zásada), hydrolýza neprechádza. K 2 SO 4 → 2 K + + SO 4 2- C) Uhličitan sodný (Na 2 CO 3) - sil, schválený so slabou kyselinou a hydroxidom sodným (na lúke, teda so silnou zásadou), na hydrolýzu podľa aniónu. CO 3 2- + H 2 O → HCO 3 - + OH - (ľahký disociačný hydrokarbonátový ión) Sadenice sú rozšírené (pH> 7). D) Sulfidový hliník (Al 2 S 3) - sil, schválený slabou hydroxidovou kyselinou a hydroxidom hliníka (slabá zásada), poskytuje opakovanú hydrolýzu zo schváleného hydroxidu hliníka: a vody Al2S3 + 6H20 → 2Al (OH)3 + 3H2S Stredný rozsah je blízky neutrálnej hodnote (pH ~ 7). Zavdannya číslo 24 Vytvorte vzor medzi konvenčnými chemickými reakciami a priamym rozpoznaním chemickej reakcie v prípade zvýšenia tlaku v systéme: pred polohou kože označenou písmenom sa pozrite na polohu daného písmena. RIVNYANNYA REAKTSI A) N2 (g) + 3H2 (g) ↔ 2NH3 (g) B) 2H2 (d) + 02 (d) ↔ 2H20 (d) C) H2 (g) + Cl2 (g) ↔ 2HCl (g) D) SO2 (g) + Cl2 (g) ↔ SO2Cl2 (g) NADYAMOK ZMISHENNYA HІMІCHNOЇ RIVNOVAGI 1) pomstiť sa za bajk rovnú reakciu 2) pomstiť sa za poburujúcu reakciu 3) neprijímajú žiadnu kompenzáciu Z písmen zapíšte číslice vibránia do tabuliek. Pohľad: А-1; B-1; mať 3; G-1 Reakciu treba nájsť v chémii, ak je rýchlosť priamej reakcie v hlavnom prúde. Usunennya rіvnovagi v požadovanom priamom dosahu mysle reakcie. Funkcionári, ktorí by mali nastúpiť na pozíciu rivnovagi: - priľnavosť: zmeniť zverák oproti reakcii bik, ale viesť k zmene hlasitosti - teplota: úprava teploty pre zmenu teploty pri bi endotermickej reakcii - koncentrácia odchádzajúcej reči a produktov v reakciách: zvýšenie koncentrácie prichádzajúcej reči a viditeľný produkt vo sfére reakcie sa mení v priamejšej reakcii (navpaki, zmena koncentrácie prichádzajúcej reči a zvýšenie produktu reakcie) - katalizátori nenalievajú rivnovagi na usunennya, ale zbavujú ich zrýchlenia A) Prvýkrát dochádza k poklesu reakcie zo zmeny množstva peňazí, fragmentov V (N 2) + 3V (H 2)> 2V (NH 3). Po posunutí ovládania systému je nevyhnutné vyhrať vraha kvôli menšiemu počtu slov, a to ešte priamočiarejšie (na priamu reakciu). B) Druhý má tiež pokles reakcie, ak dôjde k zmene množstva peňazí, fragmenty 2V (H2) + V (O2)> 2V (H2O). Po posunutí uchopenia systému môže byť ekvalizér nahradený priamou reakciou (na produkt). c) Momentálne sa reakčný čas nemení, pretože V (H 2) + V (Cl 2) = 2V (HCl), preto substitúcia nie je rovnaká. D) Štvrtý typ reakcie má tiež pokles množstva peňazí, fragmenty V (SO2) + V (Cl2)> V (SO2Cl2). Po posunutí uchopenia systému je potrebné produkt obhájiť (priama reakcia). Zavdannya č. 25 Vytvorte vzťah medzi rečovými vzorcami a činidlom, pre zvyšok ktorých je možné rozvinúť tieto vodné rozdiely: do polohy kože, označenej písmenom, zaujmite zodpovedajúcu polohu označenú číslom. FORMULI RECHOVIN A) HN03 a H20 C) NaCl a BaCl2 D) AICI3 a MgCl2 Z písmen zapíšte číslice vibránia do tabuliek. Pohľad: А-1; B-3; mať 3; G-2 A) Kyselina dusičná a voda môžu byť rozpustené pre ďalšiu soľ - uhličitan vápenatý CaCO3. Uhličitan vápenatý sa vo vode nenachádza, ale keď interaguje s kyselinou dusičnou, môže sa použiť ako dusičnan vápenatý, Ca (NO 3) 2, v prípade úplnej reakcie to vedie k vzniku oxidu uhličitého bez barov: CaCO 3 + 2HNO 3 → Ca (NO 3) 2 + CO 2 + H20 B) Chlorid vápenatý KCl a NaOH je možné vyvinúť pomocou medi (II) síranu. V prípade interakcie síranu stredného (II) s KCl výmenná reakcia neodporuje, v prítomnosti K +, Cl -, Cu 2+ a SO 4 2- nestačí vyrobiť jeden z jedna reč s nízkou disociáciou. V prípade interakcie síranu medi (II) s NaOH dochádza v dôsledku akéhokoľvek vyzrážania k výmennej reakcii hydroxidu medi (II) (základ farby blakitu). C) Chlorid sodný NaCl a BaCl 2 bárium - štandardné soli, ktoré je možné vyvinúť aj pomocou síranu stredného (II). V prípade interakcie síranu stredného (II) s NaCl výmenná reakcia neodporuje, v prítomnosti iónov Na +, Cl -, Cu 2+ a SO 4 2- nestačí vyrobiť jeden z jedného prejavu s nízkou disociáciou. V prípade interakcie síranu medi (II) s BaCl 2 dochádza v dôsledku akéhokoľvek vyzrážania k výmennej reakcii síranu bárnatého BaSO 4. D) Chlorid s hliníkom AlCl 3 a horčíkom MgCl 2 sa uvoľňujú z vody a pri interakcii s hydroxidom vápenatým sa správajú odlišne. Chlorid horečnatý z lúky spôsobí obliehanie: MgCl2 + 2KOH -» Mg (OH)2↓ + 2KCl Keď je lúka prepojená chloridom hlinitým, vzniká veľa obliehaní, takže je možné rozlíšiť roztoky komplexnej soli - tetrahydroxoaluminát vápenatý: AICI3 + 4KOH -» K + 3KCI Zavdannya číslo 26 Vytvorte vzťah medzi rečou a oblasťou: pred polohou kože označenou písmenom sa pozrite na typ polohy označený číslom. Z písmen zapíšte číslice vibránia do tabuliek. Pohľad: А-4; B-2; mať 3; G-5 A) Amiak je najdôležitejším produktom chemického priemyslu a je pravdepodobnejšie, že sa stane 130 miliónmi ton na trh. V hlavnom amiak vikoristovuyut pri odmietnutí dusíka dobrý (dusičnan a síran amónny, sechovina), likiv, vibukhovyh rechovin, kyselina dusičná, sóda. Uprostred proponovaných opcií v oblasti skladovania amiaku vyrobnitstvo láskavo (štvrťročné opcie vo forme). B) Metán je najľahší v uhľohydrátoch, tepelne najstabilnejší zástupca nízkohraničných oblastí. Yogo široko vikoristovuyut yak pobutove a promislove palivo, ako aj sirovini pre promislovostі (Ďalšia možnosť vіdpovіdі). Metán pre 90-98% є skladovacieho zemného plynu. C) Gumy sú materiály, ktoré sú posadnuté polymerizáciou na polovicu s výslednými spojmi metra. Izoprén sa považuje za tento typ na polovičný úväzok a používa sa na popretie jedného z typov gúm: D) Nízkomolekulárne alkény sa používajú na plastové materiály, etylénové vikúry sa používajú na plastové materiály, nazývané polyetylén: n CH2 = CH2 -> (-CH2-CH2-) n Zavdannya číslo 27 Vypočítajte hmotnosť dusičnanu kalórií (v gramoch), yaku po rozsahu 150 g, rozsah s hmotnostným zlomkom soli 10% pre zisk rozsahu s hmotnostným zlomkom 12%. (Zapíšte číslo do desať.) Typ: 3,4 g vysvetlenie: No tak x g - masa dusičnan kaliyu, yak razchinyayut na 150 g veľkosti. Vypočítané podľa hmotnosti dusičnanu vápenatého, rozdeleného na 150 g maloobchodné: m (KNO 3) = 150 g 0,1 = 15 g Na tento účel sa skladoval hmotnostný podiel soli 12 % a pridalo sa x g dusičnanu vápenatého. Masa urobil rozdiel na tsom (150 + x) p. Rivnyannya píše viglyad: (Zapíšte číslo do desať.) Typ: 14,4 g vysvetlenie: V dôsledku opakovaného horenia vody sa voda stáva suchou: 2H2S + 302 -> 2S02 + 2H20 Rovnako ako Avogadrov zákon, tí, ktorí vďačia za plyn tým istým mysliam, sú hlásení jedna k jednej tak, ako je, ako a niekoľko z týchto plynov. V takom poradí za rovnakú reakciu: ν (02) = 3/2ν (H2S), Tiež obshygie sirkovodnyu a sisnyu sp_invidnosit medzi sebou takto: V (02) = 3 / 2 V (H2S), V (0 2) = 3/2 6,72 l = 10,08 l, hviezdy V (0 2) = 10,08 l / 22,4 l / mol = 0,45 mol Za veľa peňazí je potrebné mať pravidelný spánok: m (02) = 0,45 mol 32 g/mol = 14,4 g Zavdannya číslo 30 Vikoristovuchi metóda elektronickej váhy, aby sa dosiahla rovnaká reakcia: Na2S03 +... + KOH → K2MnO4 +... + H20 Hľadajte oxidačné činidlo. Mn +7 + 1e → Mn +6 │2 aktualizačná reakcia S +4 - 2e → S +6 │1 oxidačná reakcia Mn +7 (KMnO 4) - oxidačný, S +4 (Na 2 SO 3) - vedúci Na2S03 + 2KMnO4 + 2KOH → 2K2MnO4 + Na2S04 + H20 Zavdannya č. 31 Zalizo sa odstránil z horúcej koncentrácie kyseliny chlorovodíkovej. Otrimanu s_l bol nasekaný príliš veľkým množstvom hydroxidu sodného. Po búrke obliehania boli filtrované a vyprážané. Otrimanu reč bola rozpálená zalizom. Zapíšte si popis reakcií. 1) Zalizo, podobne ako hliník a chróm, nereaguje s koncentrovanou kyselinou, pretože je pokrytý oxidom. Reakcia sa prejaví iba pri zahrievaní čírym plynom: 2Fe + 6H2S04 → Fe2 (SO4)2 + 3SO2 + 6H20 (pri zahrievaní) 2) Síran zaliza (III) - rozchinnaya vo vode, ktorá vstupuje do výmennej reakcie na lúke, v dôsledku čoho v obliehaní hydroxid zaliza (III) (spoluca brown colora): Fe 2 (SO 4) 3 + 3NaOH → 2Fe (OH) 3 ↓ + 3Na2S04 3) Netoxické hydroxidy kovov sa pri vyprážaní rozkladajú za vzniku oxidov a vody: 2Fe (OH)3 -> Fe203 + 3H20 4) Keď sa oxid soľného roztoku (III) zahreje, oxid soľný roztok (II) sa vytvorí s oxidom kovu (ten je v zásobe FeO, medzistupeň oxidácie): Fe 2 O 3 + Fe → 3 FeO (pri zahrievaní) Zavdannya číslo 32 Zapíšte si rovnaké reakcie, pomocou ktorých môžete urobiť nasledovné: Pred hodinou písania rіvnyan reakcie vikorizujú štruktúrne vzorce organických prejavov. 1) Intramolekulárna dehydratácia protestovala pri teplote 140 o C. Je to spôsobené rozpustením atómu z atómu na uhlíkový alkohol, ktorý sa praží cez jeden na alkoholový hydroxyl (v polohe β). CH3-CH2-CH2-OH → CH2 = CH-CH3 + H20 (umývanie - H2S04, 180 o C) Intermolekulárna dehydratácia reakcie pri teplotách nižších ako 140 o C sirupovou kyselinou sa redukuje na pridanie jednej molekuly vody k dvom molekulám alkoholu. 2) Propylén sa prenáša na asymetrický alkén. Keď sú pripojené halogenovodíky, atóm je spojený s atómom uhlíka viacnásobnou väzbou spojenou s veľkým počtom atómov vo vode: CH2 = CH-CH3 + HCl -> CH3-CHCl-CH3 3) Výmena vodného roztoku NaOH za 2-chlórpropán, atóm halogénu je nahradený hydroxylovou skupinou: CH3-CHCl-CH3 + NaOH (aq.) → CH3-CHOH-CH3 + NaCl 4) Propylén je možné odstrániť nielen propanolom-1, ale aj propanolom-2 vnútornou molekulárnou dehydratáciou pri teplote 140 o C: CH3-CH (OH) -CH3 → CH2 = CH-CH3 + H20 (umývanie H2S04, 180 o C) 5) V strede pôdy zriedime manganistan draselný vodou, získame hydroxylovaný alkén zo schválených diolov: 3CH2 = CH-CH3 + 2KMnO4 + 4H20 → 3HOCH2-CH (OH)-CH3 + 2Mn02 + 2KOH Zavdannya číslo 33 V prvom rade ide o hmotnostný podiel (%) síranu soľného (II) a sulfidu hlinitého v súčte, ak pri 25 g celkového súčtu s vodou vznikne plyn, ktorý zvýši reakciu z 960 g 5% síranu na midi (II) sulfát. Aby bolo možné zapísať približné reakcie, ktoré sú myslené v mysli úloh, to znamená viesť potrebné výpočty (uveďte jednu z fyzikálnych hodnôt, z ktorých si robíte srandu). Typ: co (Al2S3) = 40 %; ω (CuS04) = 60 % Pri spracovaní sumy síranu zalizu (II) a sulfidu hliníka s vodou sa síran jednoducho rozpadne a sulfid sa hydrolyzuje zo schváleného hydroxidu hlinitého (III) a vody: Al2S3 + 6H20 → 2Al (OH)3 ↓ + 3H2S (I) Pri prechode vody cez rozchin sulfátový midi (II) kal vipada sulfid midi (II): CuSO 4 + H 2 S → CuS ↓ + H 2 SO 4 (II) Početná váha a množstvo reči spracovanej sulfátovým midi (II): m (CuS04) = m (roztok) co (CuS04) = 960 g 0,05 = 48 g; v (CuS04) = m (CuS04) / M (CuS04) = 48 g / 160 g = 0,3 mol Pre reakciu (II) ν (CuSO 4) = ν (H 2 S) = 0,3 mol a pre reakciu (III) ν (Al 2 S 3) = 1 / 3ν (H 2 S) = 0, 1 mol Vypočítané na hmotnosť sulfidu hlinitého a midi (II) sulfátu: m (Al2S3) = 0,1 mol * 150 g / mol = 15 g; m (CuS04) = 25 g - 15 g = 10 g co (Al2S3) = 15 g / 25 g · 100 % = 60 %; ω (CuS04) = 10 g / 25 g 100 % = 40 % Zavdannya číslo 34 Keď spalyuvanny zrazka deyakoi organická spoluka s hmotnosťou 14,8 g, odstráni sa 35,2 g oxidu uhličitého a 18,0 g vody. Zdá sa, že určitá miera reči v komunite reči je na ceste 37. V čase posledného zasadnutia autorít sa vytvorila komunita reči, ktorá sa pomocou procesu premeny na oxid, bolo stanovené (II). Pri prezentácii dannyho diktujte pánovi: 1) výpočet potrebný na stanovenie molekulárneho vzorca organickej reči (uveďte počet fyzikálnych hodnôt, ktoré sa používajú na vtipkovanie); 2) zapíšte si molekulárny vzorec organickej reči; 3) pridať štruktúrny vzorec celej reči, ktorý jednoznačne predstavuje poradie atómovej väzby v molekule; 4) napíšte presnú reakciu rečového systému s oxidom medi (II), vikoristickým štruktúrnym vzorcom reči. Výsledok ADI z chémie nie je nižší, ako je stanovený minimálny počet bodov, a budem môcť vstúpiť na univerzitu v odboroch a na prelome prijímacích skúšok je predmet chémia. VNZ nepriznáva právo stanoviť minimálnu hranicu z chémie pod 36 bodov. Prestížne univerzity si spravidla stanovia svoj vlastný minimálny čas na návštevu. To je dôvod, prečo tam noví študenti môžu mať dobré vedomosti. Na oficiálnej stránke FIPI môžete zverejniť možnosti pre EDI z chémie: demonštrácia, neaktuálne obdobie. Rovnaké možnosti poskytujú oznámenie o štruktúre zdravotnej starostlivosti maybutnyy a úrovni skladateľnosti zariadenia a potrebné informácie v prípade prípravy pred EDI. Varianty EDI z chémie 2017 budú mať od posledného roku 2016 časovo zmenu, plánuje sa príprava na aktuálnu verziu a na vývoj plánovaného vývoja vypusknikova sú možnosti. prešiel. Ďalšie materiály a majetok Pre kožnú verziu vyšetrenia robota ADI z chémie sú k dispozícii nasledujúce materiály: - periodický systém chemických prvkov D.I. Mendeleva; - tabuľka rozdielov solí, kyselín a zásad vo vode; - elektrochemický rad kovových pružín. Na hodinu budete môcť použiť kalkulačku na skúšanie robotov. Prenos ďalších príloh a materiálov, ktoré sú povolené na ADI, schvaľuje príkaz Ministerstva Ruskej federácie. Pre pokojne, kto by chcel propagovať vzdelanie na univerzite, vyberte si predmety, ktoré nájdete v zozname úvodných štúdií a iných odborov Prechod prijímacích skúšok na univerzity pre všetky špecializácie (priama príprava) je predpísaný nariadením Ministerstva školstva a vedy Ukrajiny. Chudý predovšetkým hlavný sľub voľby výmeny tých predmetov, ktoré sú stanovené v ich vlastných pravidlách prijatia. Je potrebné sa oboznámiť s informáciami na webových stránkach odkazujúcich objektov, v prvom rade sa budem uchádzať o osud ADI z obrátených objektov.FORMULA RECHOVINI
REAGENCIE
Dlhodobá možnosť pre ADI z chémie 2017 rik
Rik
Vyhľadajte pokročilú možnosť
2017
variant po himii
2016
vydieranie
Demonštračná verzia ЄDI od chémie 2017 po d FIPD
Možnosť závod + vidpovidі
Pridať možnosť ukážky
Špecifikácia
demo variant himiya ege
kodifikátor
kodifikátor
(Smery školenia).