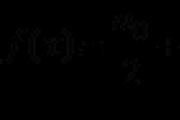Jego demo chemii. Trivality ЄDI z chemії
14 listopada 2016 roku zatwierdzona wersja została opublikowana na stronie internetowej FIPD opcje demonstracyjne, kodyfikator i specyfika materiałów kontrolnych badań jednopaństwowych i głównych badań państwowych w 2017 r., w tym chemii.
Wersja demonstracyjna ЄDI z khimiї 2017
| Opcja zavdan + vіdpovіdі | Pobierz wersję demo |
| Specyfikacja | wariant demo himiya ege |
| Kodyfikator | kodyfikator |
Wersja demonstracyjna EDI z chemii 2016-2015
| Chemia | Pobierz wersję demo + recenzje |
| 2016 | np. 2016 |
| 2015 | np. 2015 |
Na KIM z khimiї u 2017 roci suttєvі chіnі, więc wersja demonstracyjna przeszłych losów została przedstawiona w celu wyjaśnienia.
Chemia - istota zmiany: Zoptymalizowano strukturę pracy egzaminacyjnej:
1. Zasadniczo zmieniono strukturę części 1 KIM: zadanie zostało wyłączone z wyborem jednego kandydata; zadanie grupowania dla okremi bloków tematycznych, dla skórek takich є zadanie podstawowego, a zaawansowany poziom składania.
2. Zmieniono całkowitą liczbę miejsc pracy z 40 (2016) na 34.
3. Zmieniono skalę ocen (od 1 do 2 punktów) w celu określenia podstawowego poziomu fałdowania, tak aby zmieniono nabytą wiedzę o genetycznym ogniwie mowy nieorganicznej i organicznej (9. i 17.).
4. Maksymalny pierwszy wynik za zwycięską robotykę to 60 punktów (zastąpiono 64 punkty za 2016 rok).
Trivality ЄDI z chemії
Całkowity czas trwania egzaminu wynosi 3,5 roku (210 minut).
Przybliżona godzina, kiedy zaczyna się vikonanny okremikh zavdan, staje się:
1) do ustawienia skóry podstawowego poziomu składania części 1-2-3 piór;
2) do pielęgnacji skóry promowany równy składane części 1-5-7 piór;
3) do pielęgnacji skóry o wysokim stopniu pofałdowania, część 2-10-15 piór.
Specyfikacja
materiały kontrolne
za rotację United State Spitu . w 2017 r
CHEMIA
1. Powołanie KIM EDI
Jedyne doświadczenie państwowe (dalej - ЄДІ) to forma obiektywnej oceny jakości kształcenia uczniów, ponieważ opanowali oni programy kształcenia średniego edukacja globalna, Z wyboru formy znormalizowanej (materiały kontrolne).
ЄДІ być przeprowadzone zgodnie z ustawą federalną z dnia 29 grudnia 2012 r. nr 273-ФЗ „O edukacji w Federacji Rosyjskiej”.
Materiały kontrolne pozwalają ustalić poziom opanowania przez absolwentów federalnego komponentu państwowego standardu średniego (nowego) globalnego kształcenia na poziomie chemii, podstawowym i profilowym.
Wyniki jednego suwerennego badania w dziedzinie chemii są uznawane przez organizacje oświetleniowe w środku profesjonalna edukacja oraz organizacje oświetlające wyższe wykształcenie zawodowe w wyniku egzaminów wstępnych z chemii.
2. Dokumenty do wystawienia przez KIM EDI
3. Przejdź do wyboru zamiennika, analizy struktury KIM EDI
Podstawa nakładów przed dystrybucją KIM EDI 2017 z khіmії składane zagalnі metodyczne instalacje, yakі zostały wyznaczone w trakcie formowania modele egzaminacyjne wcześniejsze skały. Istotą tych instalacji jest oś y.
- КІМ jest zorientowany na ponowną weryfikację nabytego systemu wiedzy, który jest uważany za niezmienny rdzeń tych samych programów rozwojowych w chemii dla globalnych organizacji oświetleniowych. Standardowo system wiedzy jest przedstawiony jako pomoc w przygotowaniu absolwentów. Zimi vymogami spіvvіdnositsya rіvennja prіvlennya w elementach KІM vmіstu, scho verіryayutsya.
- W celu zapewnienia możliwości zróżnicowania oceny początkowych osiągnięć absolwentów KIM ЄDI zdіysnyuyut reweryfikacja opanowania głównych programów edukacyjnych z chemii na trzech poziomach złożoności: podstawowym, zaawansowanym i wysokim. Materiał początkowy, których fundamenty będą zadaniem, wybierane są na znak jego znaczenia dla edukacji globalnej absolwentów szkół ponadgimnazjalnych.
- Vikonannya zavdan ekzamenatsiynoi roboti przenoszący zdiisnennya śpiew sukupnosti diy. Wśród nich najbardziej ostentacyjne są na przykład takie: pokazywać klasyfikatorom znaki mowy i reakcji; wybierz stopień utlenienia pierwiastki chemiczne za formułami ich średników; wyjaśnij istotę tego procesu chi іnshoy, magazynu vzaєmozv'yazku, bądź tą mocą przemówień. Vmіnnya izmenovanogo zdіysnyuvati raznomanіtnі dії w vykonannye roboti jest postrzegany jako wskaźnik asymilacji skręconego materiału z niezbędną głębią zrozumienia.
- Równoważność wszystkich wariantów pracy egzaminacyjnej zapewnia wprowadzenie jednakowego poziomu kwalifikacji zadania, co jest weryfikowane poprzez przyswajanie głównych elementów kluczowych działów kierunku chemia.
4. Struktura KIM EDI
Wariant skórny pracy badawczej podpowiedzi dla jednego planu: praca składa się z dwóch części, na które składa się 40 zadań. Odcinek 1 35 dnia krótkiej przerwy, w środku 26 dzień podstawowego poziomu składania (numery seryjne rzędu: 1, 2, 3, 4, ... 26) i 9 dzień zaawansowany poziom składania (kolejność dnia zamówienia: 27, 28, 29 , …35).
Część 2, aby pomścić 5-ty dzień wysokiego poziomu składania, przy otwartym ogniu (kolejne numery tych zamówień: 36, 37, 38, 39, 40).
Typowe testy zadania chemii przeprowadzono w 10 wariantach zestawów testów, złożonych w celu poprawy niezbędnych cech oraz w trosce o samodzielny suwerenny sen w 2017 roku. Celem pomocy jest przekazanie czytelnikom informacji o strukturze badania chemii KIM 2017, stopniu złożoności zadania.
Próbnikowi opiniowano wszystkie warianty testów i podjęto decyzję o wszystkich zadaniach jednej z opcji. Ponadto, znaki puste zostały narysowane, jakby zwyciężyły na ЄDI, aby zapisać opinie o tej decyzji.
Autor jest czołowym naukowcem, urzędnikiem i metodologiem, który nieprzerwanie bierze udział w opracowywaniu kontrolnych materiałów vimiruvalnyh EDI.
Pomocnik nominacji dla nauczycieli w zakresie przygotowania uczniów do studiów chemii, a także dla uczniów szkół średnich i doktorantów – do samokształcenia i samokontroli.
zastosować.
Chlorek amonu ma wiązania chemiczne:
1) jonnі
2) kowalencyjny polarny
3) kowalencyjny niepolarny
4) woda
5) metal
Z propionowanego tłumaczenia przemówień owiń dwa przemówienia, przy czym skóra reaguje pewnymi reakcjami.
1) chlorek cynku (roztwór)
2) siarczan sodu (roztwór)
3) rozcieńczony kwas azotowy
4) stężony kwas siarkowy
5) tlenek glinu
ZMIST
Pieredmowa
Instrukcje dotyczące robota vikonanya
OPCJA 1
Część 1
część 2
OPCJA 2
Część 1
część 2
OPCJA 3
Część 1
część 2
OPCJA 4
Część 1
część 2
OPCJA 5
Część 1
część 2
OPCJA 6
Część 1
część 2
OPCJA 7
Część 1
część 2
OPCJA 8
Część 1
część 2
OPCJA 9
Część 1
część 2
OPCJA 10
Część 1
część 2
ZOBACZ RÓŻNICĘ
Vіdpovіdі do głowy części 1
Decyzja i termin wykonania części 2
Wariant zadania Razv'yazannya 10
Część 1
Część 2.
Bezpłatne zavantazhiti e-book w formacie ręcznym, podziwiaj i przeczytaj:
Pobierz książkę ЄДІ 2017, Chemia, Typowe zadania testowe, Miedwiediew Yu.M. - fileskachat.com, bezpłatne pliki do pobrania.
- ЄDI 2020, Chemia, Typowe opcje pytań egzaminacyjnych w sklepach ЄDI, Miedwiediew Yu.M., 2020
- ЄDI 2019, Chemia, Ekspert w ЄDI, Miedwiediew Yu.M., Antoshin A.E., Ryabov M.A.
- ODE 2019, Chemia. 32 opcje, Testy typu dla dystrybucji ODE, Molchanova G.M., Miedwiediew Yu.M., Koroshenko O.S., 2019
- Chemia, jedyny suwerenny test, Przygotowanie do zaświadczenia o podtorbie, Kaverina A.A., Miedwiediew Yu.M., Molchanova G.M., Sviridenkova N.V., Snastina M.G., Stakhanova S.V., 2019
Dla vikonannya zavdan 1-3 vikoristovyte następny rząd pierwiastków chemicznych. Vіdpovіddu in zavdannya 1-3 є sekwencja cyfr, pod którą wskazano pierwiastki chemiczne w ten rząd.
1) Na 2) K 3) Si 4) Mg 5) C
Kierownik nr 1
Co ważne, atomy niektórych znaczeń wielu pierwiastków mogą znajdować się na zewnątrz energia równa elektronika chotiri.
Sugestia: 3; 5
Liczba elektroniki na tym samym poziomie energetycznym (kula elektroniczna) elementów głównych podgrup jest równa liczbie grupy.
W takiej randze krzem i węgiel nadają się do składania opcji na vіdpovіdey, ponieważ smród skupuje się z podgrupy głowy czwartej grupy tabeli D.I. Mendeliew (grupa ІVA), tobto. virnі vіdpovіdі 3 i 5.
Kierownik nr 2
Z nominacji na szereg pierwiastków wybierz trzy pierwiastki, jak w układzie okresowym pierwiastków chemicznych D.I. Mendeliev dokonuje odkupu w jednym okresie. Schowaj wybrane elementy w kolejności wzrostu ich mocy metalu.
Wpisz w pole numery wybranych elementów w wymaganej kolejności.
Sugestia: 3; 4; jeden
Istnieją trzy reprezentacje pierwiastków w jednym okresie - sód Na, krzem Si i magnez Mg.
W Rosji na granicach okresu Układu Okresowego D.I. Mendeliev (poziome rzędy) praworęczny w lewo, łatwiej jest oddać elektronikę, rozkładając je na zewnętrzną kulę, tobto. metalowa moc elementów jest wzmocniona. W ten sposób w szeregu Si . wzmocniona zostaje metalowa dominacja sodu, krzemu i magnezu Kierownik nr 3 3-alternatywne wartości w wielu pierwiastkach, wybierz dwa pierwiastki, ponieważ ujawniają one niższy stopień utlenienia, równy -4. Zapisz numery wybranych elementów w polu. Sugestia: 3; 5 Z reguły oktet, atomy pierwiastków chemicznych, powinien mieć swoje własne równe elektrony na 8 poziomie elektronowym, jak w gazach szlachetnych. Co można osiągnąć albo dostarczając pozostałe elektrony, takie same jak przedni, który może pomścić 8 elektronów, albo dodając dodatkowe elektrony do ośmiu. Sód i potas przekształcają się w metale kałużowe i znajdują się w głównej podgrupie pierwszej grupy (IA). Tse oznacza, że ta sama kula elektronowa ma po jednym elektronu. W połączeniu z cym energetycznie vygіdnіshoy є vtrata pojedynczy elektron, niższy niż dodanie siedmiu kolejnych. Z magnezem sytuacja jest podobna, tylko wina znajdują się w głównej podgrupie innej grupy, więc na głównym poziomie elektronicznym znajdują się dwa elektrony. Należy zauważyć, że sód, potas i magnez są umieszczone przed metalami, a metale w zasadzie nie mogą mieć ujemnego etapu utleniania. Minimalny stopień utlenienia dowolnego metalu jest równy zeru i jest obserwowany w prostych przemówieniach. Pierwiastki chemiczne węgla C i krzemu Si є niemetali i znajdują się w głównej podgrupie czwartej grupy (IVA). Tse oznacza, że na najbardziej zewnętrznej kuli elektronowej znajdują się 4 elektrony. Dlatego do tych elementów można dostarczyć taką elektronikę, więc można dodać więcej do dużej liczby, która jest droższa 8 mil. Więcej niż 4 elektrony na atomy krzemu i węgla są niemożliwe, więc minimalny poziom utlenienia wynosi -4. Kierownik nr 4 Wybierz dwa semestry z proponowanej mieszaniny, w której występuje jonowe połączenie chemiczne. Sugestia: 1; 3 Obecność w związku wiązania typu jonowego w najistotniejszy sposób można przypisać temu, że atomy typowego metalu i atom niemetalu wchodzą jednocześnie w jedną z jednostek strukturalnych. W tym celu ustalimy, że wiązanie jonowe jest takie samo pod numerem 1 - Ca (ClO 2) 2, tk. w tej formule możliwe jest dostarczenie atomów typowego metalicznego wapnia oraz atomów niemetali - kwaśnego i chloru. Jednak nie ma już szans na zemstę na atomach metalu i niemetalu z wyznaczonej listy. Jest więcej oznak obecności wiązania jonowego w życiu codziennym, można powiedzieć, że w magazynie tej jednostki strukturalnej znajduje się kation amonowy (NH 4 +) lub jego organiczne analogi - kation alkiloamoniowy RNH 3 + , dialkiloamoniowy R2+NH23N+i tetraalkiloamoniowy R4N+, deR - deakki rodnik węglowodanowy. Na przykład, wiązanie typu jonowego można znaleźć w połączeniu (CH 3) 4NCl pomiędzy kationem (CH 3) 4 + i jonem chlorkowym Cl - . Środek nominacji w zakładzie stanowi chlorek amonu, w drugim powstaje wiązanie jonowe pomiędzy kationem amonu NH 4 + a jonem chlorku Cl − . Kierownik nr 5 Ustaw pozycję między formułą mowy a klasą / grupą, aby położyć się do rodzaju (-oї) mowy: do pozycji skóry, oznaczonej literą, wybierz pozycję z innej pozycji, wskazanej przez liczbę. Zapisz w polu cyfry wybranego dnia. Zeznanie: A-4; B-1; 3 Wyjaśnienie: Sole kwasowe nazywane są solami, które powstały w wyniku niepełnego zastąpienia w wodzie atomów rukhomi kationem metalu, kationem amonowym lub alkiloamoniowym. W kwasach nieorganicznych, które przechodzą przez program szkolny, wszystkie atomy i woda ulegają zepsuciu, dzięki czemu można je zastąpić metalem. Resztki soli kwasów nieorganicznych środowiska przedstawionego w zestawieniu to wodorowęglan amonu NH 4 HCO 3 - produkt zastąpienia jednego z dwóch atomów wody w kwasie węglowym kationem amonowym. W rzeczywistości kwaśność jest średnia pomiędzy normalną (przeciętną) kwasowością. W przypadku NH 4 HCO 3 - medium pomiędzy normalnym parapetem (NH 4) 2 CO 3 a kwasem węglowym H 2 CO 3. W wypowiedziach organicznych tylko atomy i woda zastępowane są na atomy metalu, które wchodzą do magazynu grup karboksylowych (-OOH) lub grup hydroksylowych fenoli (Ar-OH). Tobto np. octan sodu CH 3 COONa, niezależnie od tych, które w tej cząsteczce nie zawierają wszystkich atomów i podmiany wody na kationy metali, medium, a nie kwas kwaśny (!). Woda atomowa w mowach organicznych, przyłączona bez środka do atomu węgla, jest praktycznie niemożliwa do zastąpienia atomem metalu, dla wody atomowej w wodzie z potrójnym łącznikiem C-W. Tlenki nie tworzące soli - tlenki niemetali, jak utvoryut z zasadowymi tlenkami i zasadami soli, więc albo z nim nie reagują (najczęściej), albo reakcja z nim ma inny produkt (niesilny ). Często wydaje się, że tlenki niesolne to tlenki niemetali, które nie reagują z zasadami i tlenkami zasadowymi. Prote, przejawem tlenków nie tworzących soli jest taki pidhid spratsovuє zavzhd. Na przykład CO, będąc tlenkiem niesolnym, reaguje z głównym tlenkiem soli fizjologicznej (II), ale z roztworami nie soli, ale wolnego metalu: CO + FeO = CO 2 + Fe Do tlenków niesolnych w licealnym toku chemii tlenki niemetali zaliczane są na stopniu utlenienia +1 i +2. їх Usy to sustrichaetsya w ЄDI 4 - tse CO, NO, N 2 O i SiO (pozostałe SiO nie jest szczególnie sustrichavsya w zavdannya). Kierownik nr 6 Z propionowanego tłumaczenia przemówień owiń ze skóry dwa przemówienia, które dobrze reagują bez nagrzewania. Propozycja: 2; 4 Chlorek cynku dodaje się do soli, a chlorek cynku - do metali. Dopiero wtedy metal reaguje głupio, ponieważ jest jednocześnie bardziej aktywny, który trafia do magazynu soli. Znaczna aktywność metali wynika z niskiej aktywności metali (innymi słowy, serii naprężeń metali). Zalizo w szeregu aktywności metali jest bardziej odpowiednie dla cynku, ale jest mniej aktywne i nie ma większego prawdopodobieństwa w usuwaniu cynku z soli. Dlatego reakcja sali z przemówienia nr 1 nie idzie. Siarczan midi (II) CuSO 4 będzie reagował z solą fizjologiczną, ponieważ ślina jest wymieniona jako midi w serii aktywności, więc jest bardziej aktywnym metalem. Stężony kwas azotowy, a także stężony kwas siarkowy nie działa bez ogrzewania, reagując z ciepłem, glinem i chromem przy pojawieniu się takiego zjawiska, jak pasywacja: na powierzchni tych metali nie można zmienić znaczenie kwasów, bez podgrzewania siły, jak w obecności Prote po podgrzaniu łuska rozszerza się i reakcja staje się możliwa. Tobto. odłamki są przypisane, nie mogę się nagrzać, reakcja hali ze stęż. HNO 3 nie wycieka. Kwas solny można dodawać do kwasów nieutleniających niezależnie od stężenia. Reagowały z kwasami nieutleniającymi z wodą, co powinno być obok aktywności wody. Do takich metali leżą blisko. Visnovok: reakcja zalania z wyciekami kwasu solnego. W czasach metalu i tlenku metalu reakcja, podobnie jak w depresji z głupoty, jest możliwa, ponieważ bardziej aktywny metal jest dla tych, które dostają się do magazynu tlenków. Fe, bliski aktywności metali, mniej aktywny, niższy Al. Tse oznacza, że Fe s Al 2 O 3 nie reaguje. Kierownik nr 7 Z proponowanej pereliki pobierane są dwa tlenki, które reagują z różnymi kwasami chlorowodorowymi, ale nie reaguj
z różnych wodorotlenku sodu. Zapisz numery wybranych wystąpień w polu. Sugestia: 3; 4 CO jest tlenkiem niesolnym, nie wchodzi w reakcje z łąkami wodnymi. (W ślad za pamięcią, sho, nie mniej, w umysłach zhorst - wysokie ciśnienie i temperatura - wino nadal reaguje z twardą łąką, zakładając formy - sole kwasu mrówkowego.) SO 3 - tlenek siarki (VI) - kwaśny tlenek, podobny do kwasu siarkowego. Tlenki kwasowe nie reagują z kwasami i innymi tlenkami kwasowymi. Więc SO 3 nie reaguje z kwasem solnym i reaguje z zasadą - wodorotlenkiem sodu. Nie odchodź. CuO - tlenek midi (II) - może zostać doprowadzony do tlenków z główną mocą. Reaguje z HCl i nie reaguje z wodorotlenkiem sodu. Chodź MgO - tlenek magnezu - można doprowadzić do typowych tlenków podstawowych. Reaguje z HCl i nie reaguje z wodorotlenkiem sodu. Chodź ZnO jest tlenkiem o wyraźnie zaznaczonych właściwościach amfoterycznych - łatwo reaguje zarówno z mocnymi zasadami, jak i kwasami (a także tlenkami kwasowymi i zasadowymi). Nie odchodź. Kierownik nr 8 Propozycja: 4; 2 Podczas reakcji z dwiema solami kwasów nieorganicznych prawdopodobieństwo rozpuszczenia gazu jest mniejsze, gdy gorące azotyny i sole amonowe mieszają się po rozpuszczeniu niestabilnego termicznie azotynu amonu. Na przykład, NH 4 Cl + KNO 2 \u003d to \u003d\u003e N 2 + 2H 2 O + KCl Na liście nie ma jednak azotynów i soli amonowych. Również jedna z trzech soli (Cu(NO 3) 2 , K 2 SO 3 i Na 2 SiO 3) reaguje albo z kwasem (HCl) albo z łąką (NaOH). Wśród soli kwasów nieorganicznych tylko sole amonu widzą gaz podczas interakcji z łąkami: NH 4 + + OH \u003d NH 3 + H 2 O Sól amonowa, jak już powiedzieliśmy, nie ma listy. Nie ma już możliwości interakcji soli z kwasem. Do soli o środku znaczenia przemówień połóż Cu (NO 3) 2, K 2 SO 3 i Na 2 SiO 3. Reakcja midi azotanu z kwasu solnego nie przebiega, ponieważ nie zadowalaj się gazem, oblężeniem ani mową o niskiej dysocjacji (ołów lub słaby kwas). Krzemian sodu reaguje z kwasem solnym; Na 2 SiO 3 + 2HCl \u003d 2NaCl + H 2 SiO 3 ↓ Zrezygnowano z pozostałej opcji - interakcji siarczynu potasu i kwasu solnego. Rzeczywiście, w wyniku reakcji wymiany jonowej między siarczynem a praktycznie dowolnym kwasem, kwas niesiarkowy ulega rozpuszczeniu, w rzeczywistości rozkłada się na bezbarwny gazopodobny tlenek siarki (IV) i wodę. Kierownik nr 9 Wpisz do tabeli numery wybranych wystąpień pod odpowiednimi literami. Propozycja: 2; 5 CO 2 zostaje doprowadzony do tlenków kwaśnych i aby zamienić go w życie, konieczne jest podniesienie go za pomocą tlenku zasadowego lub zasady. Tobto. Aby usunąć węglan potasu z CO 2, konieczne jest dodanie do niego tlenku potasu lub wodorotlenku potasu. W tej kolejności mowa X to tlenek potasu: K 2 O + CO 2 \u003d K 2 CO 3 Wodorowęglan potasu KHCO 3, jak i węglan potasu, є sіllyu vugіlnoї kwas, sієyu mniejsza różnica, scho wodorowęglan є produkt niepełnego zastąpienia atomów w wodzie z kwasu vugіlnіy. Aby usunąć normalną (średnią) sól, moc kwasową, konieczne jest podniesienie jej za pomocą ciężkiego kwasu, który jest mocą ustaloną, lub podniesienie jej za pomocą tlenku kwasowego, który zaostrza ten kwas, w obecności woda. Tak więc odczynnik Y jest dwutlenkiem węgla. Kiedy joga przechodzi przez roztwór wodny, węglan potasu pozostaje, aby przejść do wodorowęglanu potasu: K 2 CO 3 + H 2 O + CO 2 \u003d 2KHCO 3 Kierownik nr 10 Ustaw różnicę między reakcjami i mocą pierwiastka na azot, jak gdyby była w twojej reakcji: na pozycję skóry, oznaczoną literą, aby zająć właściwą pozycję, oznaczoną cyfrą. Wpisz do tabeli numery wybranych wystąpień pod odpowiednimi literami. Zeznanie: A-4; B-2; W 2; G-1 A) NH 4 HCO 3 - moc, do magazynu, w skład którego wchodzi kation amonowy NH 4 +. W kationie amonowym azot jest głównym etapem utleniania, który wynosi -3. W wyniku reakcji wino przekształca się w amoniak NH3. Woda jest praktycznie zavzhdi (krim yogo spoluk z metalami) maє etapy utleniania, co jest dobre +1. Ponieważ cząsteczka amoniaku była elektrycznie obojętna, to azot jest odpowiedzialny za matkę etapu utleniania, który jest zdrowy -3. Otzhe, zmiana etapu utleniania do azotu nie jest możliwa, tobto. wina nie wykazują dominujących właściwości tlenkowych. B) Jak pokazano powyżej, azot w amoniaku NH3 można utlenić do -3. W wyniku reakcji z CuO amoniak przekształca się w prostą mowę N 2 . W obecności prostej mowy etapy utleniania pierwiastka, jak gdyby zostało ustalone, są równe zeru. W ten sposób atom azotu traci swój ładunek ujemny, a odłamki ładunku ujemnego oddają elektrony, co oznacza, że atom azotu traci go w wyniku reakcji. Pierwiastek, który w wyniku reakcji traci część swoich elektronów, nazywany jest źródłem. C) W wyniku reakcji NH 3 z etapem utleniania do azotu, który prowadzi do -3, przekształca się w tlenek azotu NO. Kisen praktycznie sadzą najwyższy stopień utlenienia, który jest dobry -2. Aby cząsteczka tlenku azotu była elektrycznie obojętna, atom azotu odpowiada za matkę stanu utlenienia +2. Tse oznacza, że atom azotu po reakcji zmienia swój stopień utlenienia z -3 na +2. Nie warto mówić o utracie 5 elektronów przez atom azotu. Azot Tobto, jak i trapleyaetsya B, є vіdnovnikom. D) N 2 - prosta mowa. We wszystkich prostych przemówieniach pierwiastek, który je tworzy, może mieć zdrowy stan utlenienia 0. W wyniku reakcji azot przekształca się w azotek litu Li3N. Pojedynczy stopień utlenienia metalu kałuży, krem zerowy (stopień utlenienia 0 można znaleźć w każdym pierwiastku), dobry +1. W ten sposób, aby jednostka strukturalna Li3N była elektrycznie obojętna, azot odpowiada za matkę etapów utleniania, czyli -3. Wychodzą, w wyniku reakcji azot uzyskał ładunek ujemny, co oznacza przybycie elektronów. Azot w tej reakcji utlenia się. Kierownik nr 11 Aby ustalić pozycję między formułą mowy a odczynnikami, ze skórą dowolnej z tych mowy można połączyć: z pozycją skóry, oznaczoną literą, aby zająć prawidłową pozycję, oznaczoną liczbą. D) ZnBr 2 (roztwór) 1) AgNO 3, Na 3 PO 4, Cl 2 2) BaO, H2O, KOH 3) H 2, Cl 2, O 2 4) HBr, LiOH, CH3COOH 5) H 3 PO 4, BaCl 2, CuO Wpisz do tabeli numery wybranych wystąpień pod odpowiednimi literami. Zeznanie: A-3; B-2; W 4; G-1 A) Kiedy woda gazopodobna przechodzi przez stopienie sirka, ustala się woda krążąca H 2 S: H 2 + S \u003d to \u003d\u003e H 2 S Gdy chlor jest przepuszczany przez ustawioną siarkę w temperaturze pokojowej, dichlorek siarki rozpuszcza się: S + Cl 2 \u003d SCl 2 Do budynki EDI wiem na pewno, jak sirka reaguje z chlorem i nie trzeba tego rejestrować. Golovnya - na zasadniczym poziomie pamięci reaguje scho sirka іz chlor. Chlor jest silnym środkiem utleniającym, sirka często wykazuje podstawową funkcję – jak utleniacz, więc jest energetyzujący. Tobto, podobnie jak silny środek utleniający, taki jak cząsteczkowy chlor Cl 2, zostanie utleniony. Sirka pali niebieskie półświatła w pobliżu kwaśnego gazu o silnym zapachu - dwutlenek siarki SO 2: B) SO 3 - tlenek siarki (VI) może wyraźnie wykazywać moc kwasową. Dla takich tlenków najbardziej charakterystycznymi reakcjami są oddziaływania z wodą, a także z tlenkami i wodorotlenkami zasadowymi i amfoterycznymi. Lista pod numerem 2 obejmuje wodę, zasadowy tlenek BaO i wodorotlenek KOH. Kiedy kwaśny tlenek wchodzi w interakcję z zasadowym tlenkiem, siła kwasu kwaśnego i metalu ulega rozpuszczeniu, które wchodzi do magazynu tlenku zasadowego. W przypadku tlenku kwasowego dodaje się ten kwas, w którym pierwiastek kwasotwórczy może mieć taki sam stopień utlenienia jak tlenek. Tlenek SO 3 jest traktowany kwasem siarkowym H 2 SO 4 (a tam i tam etap utleniania jest bardziej zaawansowany +6). W ten sposób wraz z oddziaływaniem SO 3 z tlenkami metali powstaną sole kwasu siarkowego – siarczan, które zastąpią jon siarczanowy SO 4 2-: SO 3 + BaO = BaSO 4 Podczas interakcji z wodą kwaśny tlenek przekształca się w kwas kwaśny: SO 3 + H 2 O \u003d H 2 SO 4 A wraz z oddziaływaniem kwaśnych tlenków z wodorotlenkami metali rozpuszcza się siła kwaśnej wody uwodnionej: SO 3 + 2KOH \u003d K 2 SO 4 + H 2 O C) Wodorotlenek cynku Zn(OH) 2 może mieć rodzaj mocy amfoterycznej, dzięki czemu reaguje zarówno z tlenkami i kwasami kwaśnymi, jak iz zasadowymi tlenkami sodu. Na liście znajdują się 4 bachimy jako kwasy - brom-woda HBr i otsov oraz łąka - LiOH. Zgadnijmy, jakie łąki nazywane są wodorotlenkami wody: Zn(OH)2 + 2HBr = ZnBr2 + 2H2O Zn (OH) 2 + 2CH 3 COOH \u003d Zn (CH 3 COO) 2 + 2H 2 O Zn(OH) 2 + 2LiOH \u003d Li 2 D) Bromek cynku ZnBr 2 є sіllu, rozchinny v vodі. W przypadku soli detalicznych najbardziej rozpowszechnione reakcje wymiany jonowej. Siła może reagować z inną siłą dla umysłu, że obelgi soli wihdnі rozprzestrzeniają się i następuje oblężenie. Również ZnBr 2 opóźnia jon bromkowy Br-. W przypadku metalohalogenków charakterystyczne jest to, że smród budynku reaguje z halogenami Hal 2, których więcej znajduje się w tablicach Mendelieva. O taką rangę? opisy rodzajów reakcji pochodzą z listy 1: ZnBr 2 + 2AgNO 3 \u003d 2AgBr + Zn (NO 3) 2 3ZnBr 2 + 2Na 3 PO 4 = Zn 3 (PO 4) 2 + 6NaBr ZnBr2 + Cl2 = ZnCl2 + Br2 Kierownik nr 12 Ustaw pozycję między nazwą przemówienia a klasą/grupą, do jakiej (-ї) ma się położyć przemówienie: do pozycji skóry, oznaczonej literą, wybierz właściwą pozycję, oznaczoną cyfrą. Wpisz do tabeli numery wybranych wystąpień pod odpowiednimi literami. Zeznanie: A-4; B-2; W 1 Wyjaśnienie: A) Metylobenzen jest taki sam jak toluen, ale wzór strukturalny to: O ile to możliwe, cząsteczki tej mowy są sfałdowane tylko w węgiel i wodę, więc metylobenzen (toluen) jest dodawany do węglowodanów B) Wzór strukturalny aniliny (aminobenzenu) jest następujący: Ponieważ można prześledzić wzór strukturalny, cząsteczka aniliny składa się z aromatycznego rodnika węglowodanowego (C6H5-) i grupy aminowej (-NH2), w tej kolejności anilina jest doprowadzona do amin aromatycznych, tobto. poprawna sugestia 2. C) 3-metylobutanal. Koniec „al” to rozmowa o tych, których mowa sięga aldehydów. Strukturalna formuła mowy: Kierownik nr 13 Z proponowanej pereliki zawiń dwa przemówienia, yakі є strukturalne izomery butenu-1. Zapisz numery wybranych wystąpień w polu. Propozycja: 2; 5 Wyjaśnienie: Izomery nazywane są przemówieniami, które mają ten sam wzór cząsteczkowy i wartość strukturalną, to znaczy. przemówienia, które wyróżnia kolejność atomów, ale także sam magazyn cząsteczek. Kierownik nr 14 Z proponowanego zawinięcia perelіku dwa słowa, w przypadku interakcji z nadmanganianem potasu, będzie można zmienić zabarvlennya rozchiny. Zapisz numery wybranych wystąpień w polu. Sugestia: 3; 5 Wyjaśnienie: Alkany, a także cykloalkany z rozszerzeniem pierścienia o 5 lub więcej atomów węgla, są obojętne i nie reagują z roztworami wodnymi, tworząc silne środki utleniające, takie jak np. nadmanganian potasu KMnO 4 i dichromian potasu K 2 Cr 2 O 7. W ten sposób wypadają opcje 1 i 4 - gdy do poziomu wody nadmanganianu potasu doda się cykloheksan lub propan, nie nastąpi zmiana zanieczyszczenia. Spośród węglowodanów w szeregu homologicznym benzenu jest pasywny wobec różnych wodnych odmian utleniania tylko benzenu, homologi pan są utleniane odłomowo w środku lub do kwasów karboksylowych lub do soli hydroksylowych. W tej kolejności spada wariant 2 (benzen). Właściwe to 3 (toluen) i 5 (propylen). Obraźliwe przemówienia drażnią fioletowy kolor nadmanganianu potasu poprzez przeregulowanie reakcji: CH3 -CH \u003d CH2 + 2KMnO4 + 2H2O → CH3 -CH (OH) -CH2OH + 2MnO2 + 2KOH Kierownik nr 15 Z proponowanej mieszaniny zawiń dwa słowa z reakcjami formaldehydu. Zapisz numery wybranych wystąpień w polu. Sugestia: 3; 4 Wyjaśnienie: Formaldehyd wprowadzany jest do klasy aldehydów – kwaśnych związków organicznych, które na końcu cząsteczki mogą tworzyć grupę aldehydową: Typowymi reakcjami aldehydów są reakcje utleniania i odnowy zachodzące wzdłuż grupy funkcyjnej. W środku zmiany reakcji na formaldehyd, charakterystyczną reakcją jest odnowa, jak zastępcza woda (kat. - Pt, Pd, Ni) i utlenianie - w innej reakcji srebrnego lustra. Po dodaniu wody na katalizatorze niklowym formaldehyd przekształca się w metanol: Reakcja lustra srebrnego jest reakcją odkrycia różnicy między tlenkiem amoniaku srebra. Z różnicą w wodnym amoniaku, tlenek srebli zamienia się w złożoną formę - wodorotlenek diaminosrebra (I) OH. Po dodaniu formaldehydu zachodzi reakcja utleniająco-utleniająca, w której obserwuje się: Kierownik №16 Z zaproponowanej mieszaniny zawiń dwa słowa z reakcjami metyloaminy. Zapisz numery wybranych wystąpień w polu. Propozycja: 2; 5 Wyjaśnienie: Metyloamina jest najprostszym przejawem związków organicznych w klasie amin. Cechą charakterystyczną amin jest obecność nieustalonego elektronu na atomach azotu, po czym aminy wykazują moc zasad, a reakcje pełnią rolę nukleofilów. W ten sposób w połączeniu z cymiz proponowanymi wariantami metyloaminy jako zasady nukleofil reaguje z chlorometanem i kwasem solnym: CH 3 NH 2 + CH 3 Cl → (CH 3) 2 NH 2 + Cl - CH3NH2 + HCl → CH3NH3 + Cl - Kierownik №17 Plan transformacji przemówień ma nadejść: Vznachte, yakі іz zaznachenih speechovina є speechovina X i Y. Wpisz do tabeli numery wybranych wystąpień pod odpowiednimi literami. Propozycja: 4; 2 Wyjaśnienie: Jedną z reakcji jest zatrzymywanie alkoholi i reakcja hydrolizy haloalkanów. W ten sposób można pobrać etanol z chloroetanu wypijając go na pozostałej łące wodnej - w tej kropli NaOH. CH3CH2Cl + NaOH (aq.) → CH3CH2OH + NaCl reakcja obraźliwa є reakcja utleniania alkohol etylowy. Utlenianie alkoholi odbywa się na katalizatorze środkowym lub na bazie miedzi CuO: Kierownik №18 Ustaw różnicę między nazwą mowy a produktem, który jest ważniejszy do ustalenia w interakcji mowy z bromem: na pozycję skóry, oznaczoną literą, aby zająć drugą pozycję, oznaczoną cyfrą. Odpowiedź: 5; 2; 3; 6 Wyjaśnienie: W przypadku alkanów najbardziej charakterystycznymi reakcjami są reakcje podstawienia wolnorodnikowego, w których atom wody zostaje zastąpiony atomem halogenu. W tej kolejności bromujący etan można usunąć brometan, a bromujący izobutan – 2-bromoizobutan: Rozpraszacze małych cykli cząsteczek cyklopropanu i cyklobutanu są niestabilne, gdy bromowane cykle tych cząsteczek są zakrzywione tak, że reakcja przebiega: Na podstawie cykli cyklopropanu i cyklobutanu, cykl cykloheksanu wielkich rozmarynów, po którym zastąpienie atomu wody atomem bromu: Kierownik nr 19 Ustal różnicę między reaktywnymi przemówieniami a produktem, który mści węgiel, który osiada z interakcją tych przemówień: do pozycji skóry, oznaczonej literą, zajmij właściwą pozycję, oznaczoną cyfrą. Zapisz w tabeli wybrane liczby pod podwójnymi literami. Odpowiedź: 5; 4; 6; 2 Menedżer №20 Z zaproponowanej listy typów reakcji należy wybrać dwa typy reakcji, do których można wprowadzić w połączeniu z metalami kałużowymi z wody. Zapisz w polu numery wybranych typów reakcji. Sugestia: 3; 4 Baseny metalowe (Li, Na, K, Rb, Cs, Fr) znajdują się w głównej podgrupie grupy I tabeli D.I. Zwolennicy Mendeliewa, z łatwością przenoszący elektron, rozchodzą się na równi. Jeśli oznaczysz metal jeziorkowy literą M, to reakcja metalu jeziorkowego z wodą będzie wyglądać następująco: 2M + 2H2O → 2MOH + H2 Kałuże były jeszcze bardziej aktywne, gdy zostały wyciągnięte do wody. Reakcja przebiega burzliwie od wizji świetny numer ciepło, nieodwracalne i nie zmieniające katalizatora (niekatalityczne) - mowa, która przyspieszy reakcję i nie wejdzie do magazynu produktów reakcji. Znamienne, że wszystkie reakcje egzotermiczne nie zmieniają katalizatora i przebiegają nieodwołalnie. Odłamki metalu i wody to mowa, która w różnych młynach kruszyw, gdzie reakcja zachodzi między fazami, jest również niejednorodna. Rodzaj reakcji to substytucja. Reakcje między mowami nieorganicznymi sprowadzane są do reakcji substytucji, w wyniku czego mowa prosta zostaje zwinięta iw efekcie inne mowy proste i złożone. (Reakcja neutralizacji przebiega między kwasem a zasadą, w wyniku czego mowa jest wymieniana z jej częściami magazynowymi i staje się mową mocniejszą i mniej zdysocjowaną). Jak wspomniano powyżej, kałuże zostały wyrzucone przez odkrywców, wypuszczając elektron z zewnętrznej kuli, a reakcja utleniała się i utleniała. Kierownik №21 Z proponowanej remiksu naparów ovnishnіh zawiń dwa napary, jakby chciał zmienić szybkość reakcji etylenu z wodą. Zapisz w polu numery wybranych połączeń. Sugestia: 1; 4 za szwedzkość reakcje chemiczne dodaj takie czynniki: zmianę temperatury i stężenia odczynników, a także zmienną katalizatora. Zgodnie z empiryczną zasadą Van't Hoffa, gdy temperatura na skórze wzrasta o 10 stopni, stała jednorodności jednorodnej reakcji wzrasta 2-4 razy. Zmień również temperaturę, aby zmniejszyć szybkość reakcji. Pierwsza opcja to chodzenie. Jak zaznaczono wyżej, dodaje się szybkość reakcji i zmienia się stężenie odczynników: jeśli stężenie etylenu wzrasta, to wzrost i szybkość reakcji nie pomaga roślinie. A zmiana stężenia wody - składnik aktywny z kolei zmniejsza szybkość reakcji. Również druga opcja nie jest odpowiednia, ale czwarta opcja jest odpowiednia. Mowa jest katalizatorem, który przyspieszy szybkość reakcji chemicznej, ale nie wejdzie do magazynu produktu. Zmiana katalizatora przyspieszy reakcję uwodornienia etylenu, co również nie świadczy o sposobie myślenia zakładu, że nie jest to właściwy sposób. Gdy etylen wchodzi w interakcję z wodą (na katalizatorach Ni, Pd, Pt), etan rozpuszcza się: CH2 \u003d CH2 (g) + H2 (g) → CH3-CH3 (g) Wszystkie składniki, które zawiera reakcja, a produkt są gazopodobnymi rechowinami, również na ciśnienie układu wpływa również szybkość reakcji. Dwukrotnie zużywany jest etylen, a jeden jest zaspokajany wodą, a następnie reakcja na zmianę ciśnienia w układzie. Naciskając ciśnienie, przyspieszymy reakcję. P'yata vіdpovіd nie przyszedł. Kierownik №22 Aby ustalić różnicę między formułą soli a produktami przez elektrolizę wodnego roztworu soli, jak widać na elektrodach obojętnych: do pozycji skóry, Formuła soli PRODUKTY DO ELEKTROLIZY Zapisz w tabeli wybrane liczby pod podwójnymi literami. Sugestia: 1; 4; 3; 2 Elektroliza to proces utleniania i utleniania, który zachodzi na elektrodach podczas przechodzenia stałego strumienia elektrycznego przez otwarcie i topienie elektrolitu. Na katodzie należy zwrócić uwagę na obecność cichych kationów, które mogą mieć największą aktywność tlenkową. Na anodach w pierwszej kolejności te aniony są utleniane, tak jakby mogły być najważniejszym budynkiem. Elektroliza wody 1) Proces elektrolizy zmian wody na katodzie nie powinien być osadzony zgodnie z materiałem katody, ale raczej zgodnie z położeniem kationu metalu w elektrochemicznym szeregu napięć. Dla kationów z rzędu Proces odnawiania Li+ - Al 3+: 2H 2 O + 2e → H 2 + 2OH - (H 2 jest widoczny na katodzie) Proces renowacji Zn 2+ - Pb 2+: Me n + + ne → Me 0 ta 2H 2 O + 2e → H 2 + 2OH - (H 2 ta Me widać na katodzie) Cu 2+ - Au 3+ proces odnawiania Me n + + ne → Me 0 (me jest widoczne na katodzie) 2) Proces elektrolizy różnic wody na anodzie ma być osadzony zgodnie z materiałem anodowym i charakterem anionu. Jak anoda nie jest otwarta, tobto. obojętne (platyna, złoto, vugilla, grafit), wtedy proces jest nieświeży tylko w postaci anionów. Dla anionów F -, SO 4 2-, NO 3 -, PO 4 3-, OH - proces utleniania: 4OH - - 4e → O 2 + 2H 2 O lub 2H 2 O - 4e → O 2 + 4H + (na anodzie widać tlen) jony halogenkowe (crim F-) proces utleniania 2Hal - - 2e → Hal 2 ) organiczne proces utleniania kwasów: 2RCOO - - 2e → R-R + 2CO 2 Całkowicie równa energii elektrycznej: A) różnica między Na 3 PO 4 2H 2 O → 2H 2 (na katodzie) + O 2 (na anodzie) B) różnica KCl 2KCl + 2H 2 O → H 2 (na katodzie) + 2KOH + Cl 2 (na anodzie) C) różnica między CuBr2 CuBr 2 → Cu (na katodzie) + Br 2 (na anodzie) D) rozkład Cu(NO3)2 2Cu (NO 3) 2 + 2H 2 O → 2Cu (na katodzie) + 4HNO 3 + O 2 (na anodzie) Kierownik №23 Ustaw różnicę między nazwą soli a ustawieniem soli na hydrolizę: do pozycji skóry, oznaczonej literą, wybierz prawidłową pozycję, oznaczoną cyfrą. Zapisz w tabeli wybrane liczby pod podwójnymi literami. Sugestia: 1; 3; 2; 4 Hydroliza soli - oddziaływanie soli z wodą, które prowadzi do przyłączenia cząsteczek kationu wody H+ do anionu nadmiaru kwasowego i (lub) grupy hydroksylowej OH - cząsteczki wody do kationu metalu. Hydrolizę przeprowadza się za pomocą soli nasyconych kationami, które są odpowiednie dla słabych zasad i anionów, które są odpowiednie dla słabych kwasów. A) Chlorek amonu (NH 4 Cl) - mocny, wytwarzany z mocnego kwasu solnego i amoniaku (słaba zasada), ulegający hydrolizie przez kation. NH 4 Cl → NH 4 + + Cl - NH 4 + + H 2 O → NH 3 H 2 O + H + (rozpuszczony w wodzie amoniak) Środek jest kwaśny (pH< 7). B) Siarczan potasu (K 2 SO 4) - mocny, wytwarzany z mocnego kwasu siarkowego i wodorotlenku potasu (łąka, która jest mocną zasadą), hydroliza nie jest dozwolona. K 2 SO 4 → 2K + + SO 4 2- C) Węglan sodu (Na 2 CO 3) - mocny, wytworzony ze słabego kwasu węglowego i wodorotlenku sodu (łąka, czyli mocna zasada), podlegający hydrolizie przez anion. CO 3 2- + H 2 O → HCO 3 - + OH - (podświetlenie słabo zdysocjowanego jonu wodorowęglanowego) Środkowa część kałuży (pH>7). D) Siarczek glinu (Al 2 S 3) - wytrzymałość, hartowany słabym kwasem moczowym i wodorotlenkiem glinu (słaba zasada), podlegający całkowitej hydrolizie z domieszką wodorotlenku glinu i diuretyku: Al2S3 + 6H2O → 2Al(OH)3 + 3H2S Środek jest zbliżony do neutralnego (pH ~ 7). Kierownik №24 Aby ustalić różnicę między równymi reakcjami chemicznymi i bezpośrednio z zastosowaniem wyrównania chemicznego przy zwiększonym ciśnieniu w układzie: do pozycji skóry, oznaczonej literą, do zajęcia drugiej pozycji, wskazanej przez liczbę. REAKCJE REAKCJI A) N2(g) + 3H2(g) 2NH3(g) B) 2H2(g) + O2(g) 2H2O(g) C) H 2 (g) + Cl 2 (g) ↔ 2HCl (g) D) SO 2 (g) + Cl 2 (g) ↔ SO 2 Cl 2 (g) BEZPOŚREDNI PROJEKT CHEMICZNEJ RIVNOVAGI 1) przejście od reakcji bezpośredniej 2) zm_shchuєtsya w reakcji rowerowej zvorotnoї 3) nie ma zmiany zazdrości Zapisz w tabeli wybrane liczby pod podwójnymi literami. Zeznanie: A-1; B-1; O 3; G-1 Reakcja jest znana w stosunku chemicznym, jeśli nasilenie reakcji bezpośredniej jest większe niż nasilenie surowicy. Usunennya ryvnovagi u potrzebujących bezpośrednio dochodzi do zmiany umysłów reakcji. Urzędnicy, którzy podpisują stanowisko zazdrości: - wice: zbіlshennya vice zmіschuє r_vnovag na bіk reakcji, scho prowadzące do zmiany głośności - temperatura: wzrost temperatury i kompensacja wyrównania reakcji endotermicznej roweru - stężenia zewnętrznych produktów mowy i reakcji: wzrost koncentracji mowy zewnętrznej i spadek produktów reakcji w sferze reakcji - Katalizatory nie plują na przejęcie zazdrości, a raczej przyspieszają osiągnięcie A) Na pierwszym etapie reakcja na zmianę z powodu zmian, skalowanie V (N 2) + 3 V (H 2)\u003e 2 V (NH 3). Naciskanie presji na system jest równoznaczne z pomszczeniem zabójstwa z mniej popularnych przemówień, a następnie bezpośrednio (zabicie bezpośredniej reakcji). B) W inny sposób reakcja jest taka sama dla zmian, skale to 2V (H2) + V (O2) > 2V (H2O). Naciskając ciśnienie na system, wyrównaj ciśnienie na reakcję bezpośrednią (na produkt). c) Jednocześnie nie zmienia się czas reakcji, ponieważ V (H 2) + V (Cl 2) \u003d 2 V (HCl), nie ma równego odchylenia. D) W fazie czwartej reakcja też jest taka sama jak zmiana, skale to V(SO2) + V(Cl2) > V(SO2Cl2). Wypychanie ciśnienia na układ, wyrównywanie ciśnienia na produkt (reakcja bezpośrednia). Kierownik №25 Ustaw różnicę między formułami mowy a odczynnikiem, za pomocą którego możesz oddzielić różnice w wodzie: do pozycji skóry, oznaczonej literą, wybierz prawidłową pozycję, oznaczoną liczbą. FORMUŁA MOWY A) HNO 3 i H 2 O C) NaCl i BaCl 2 D) AlCl3 i MgCl2 Zapisz w tabeli wybrane liczby pod podwójnymi literami. Zeznanie: A-1; B-3; O 3; G-2 A) Kwas azotowy i wodę można rozdzielić na dodatkową sól - węglan wapnia CaCO3. Węglan wapnia nie różni się w wodzie, ale w interakcji z kwasem azotowym powoduje różnicę w sile - azotan wapnia Ca (NO 3) 2, z którym reakcji towarzyszą wizje nagiego dwutlenku węgla: CaCO 3 + 2HNO 3 → Ca(NO 3) 2 + CO 2 + H 2 O B) Chlorek potasu KCl i łąkowy NaOH można oddzielić różnymi midi siarczanami (II). W oddziaływaniu midi(II)siarczanu z KCl reakcja wymiany nie przebiega, jony K+, Cl -, Cu 2+ i SO 4 2- są obecne w różnym stopniu, mało rozpuszczają się jednym z niską dysocjacją przemówienie. We współdziałaniu siarczanu midi(II) z NaOH zachodzi reakcja wymiany, w wyniku której wytrąca się wodorotlenek midi(II) (podstawa barwy czarnej). C) Chlorek sodu NaCl i baru BaCl 2 - sole detaliczne, a także siarczan detaliczny midi (II). W oddziaływaniu midi(II)siarczanu z NaCl reakcja wymiany nie przebiega, jony Na+, Cl -, Cu 2+ i SO 4 2- są obecne w różnym stopniu, mało rozpuszczają się jeden przy jednym o niskiej dysocjacji przemówienie. Podczas interferencji z siarczanem midi(II) i BaCl2 zachodzi reakcja wymiany, w wyniku której wytrąca się siarczan baru BaSO4. D) Chlorek glinu AlCl3 i magnez MgCl2 różnią się w wodzie i zachowują się inaczej podczas interakcji z wodorotlenkiem potasu. Chlorek magnezu z łąki rozpoczyna oblężenie: MgCl2 + 2KOH → Mg(OH)2 ↓ + 2KCl Podczas interakcji z łąką z chlorkiem glinu powstaje osad, który następnie różni się od rozpuszczonej soli złożonej - tetrahydroksoglinianu potasu: AlCl3 + 4KOH → K + 3KCl Kierownik №26 Ustaw pozycję między obszarem mowy a obszarem stosuvannya: do pozycji skóry, wskazanej literą, wybierz prawidłową pozycję, wskazaną liczbą. Zapisz w tabeli wybrane liczby pod podwójnymi literami. Zeznanie: A-4; B-2; O 3; G-5 A) Ammiak jest najważniejszym produktem przemysłu chemicznego, a jego produkcja wynosi ponad 130 milionów ton na rzekę. Zasadniczo amoniak jest żywy w obecności dodatków azotowych (azotan i siarczan amonu, sechowin), alkoholu, przemówień wibukowych, kwasu azotowego, sody. Środek proponowanych wariantów skutków sfery stagnacji amoniaku i virobnitstvo dobriv (czwarty wariant skutków). B) Metan jest najprostszym węglowodanem, najbardziej stabilnym termicznie przedstawicielem niskich warstw granicznych. Yogo jest szeroko vikoristovuyut jak pobutov i promyslov palivo, a także syrovini dla promyslovnosti (inny wariant vіdpovidі). Metan na 90-98% є magazynowy gaz ziemny. C) Guma to nazwa nadana materiałom, które mają obsesję na punkcie polimeryzacji w wyniku uzyskiwania połączeń subtraktywnych. Izopren może być sprowadzony do tego typu średnikami i zwycięski w wyborze jednego rodzaju gumy: D) Alkeny o niskiej masie cząsteczkowej są poddawane vicoration dla tworzyw sztucznych, podczas gdy vicorors etylenowe są vicorated dla tworzyw sztucznych zwanych polietylenem: n CH 2 \u003d CH 2 → (-CH 2 -CH 2 -) n Kierownik nr 27 Obliczyć masę azotanu potasu (w gramach) w następujący sposób: w 150 g różnica z udziałem masowym soli wynosi 10%, w przypadku zawartości różnica dotyczy ułamka masowego 12%. (Zapisz liczbę z dokładnością do dziesięciu.) Wartość: 3,4g Wyjaśnienie: Niech x g - masa azotanu potasu, jaka rozchinyayat 150 g razchinya. Obliczamy masę azotanu potasu podzieloną na 150 g: m(KNO 3) \u003d 150 g 0,1 \u003d 15 g Aby dodać 12% udziału masowego soli, dodaj x g azotanu potasu. Masa złożyła różnicę na tsioma (150+x) r. Rivnyannya zostanie napisane na widok: (Zapisz liczbę z dokładnością do dziesięciu.) Widpowid: 14,4 g Wyjaśnienie: W wyniku powtarzającego się łuszczenia się wody obiegowej dwutlenek siarki i woda ulegają rozpuszczeniu: 2H2S + 3O2 → 2SO2 + 2H2O Zgodnie z prawem Avogadro, ci, którzy mają obsesję na punkcie gazów, którzy są w tych samych umysłach, są postrzegani jeden do jednego, podobnie jak liczba tych gazów. W tej kolejności dla równych reakcji: ν(O2) = 3/2ν(H 2 S), odtąd obsyagi sіrkovodnya i kwaśność spіvvіdnosya między sobą w ten sposób: V (O 2) \u003d 3 / 2 V (H 2 S), V (O 2) \u003d 3/2 6,72 l \u003d 10,08 l, gwiazdki V (O 2) \u003d 10,08 l / 22,4 l / mol \u003d 0,45 mol Obliczmy masę kwaśności, potrzebę nowego łuszczenia się sirkovodnya: m(O 2) \u003d 0,45 mol 32 g / mol \u003d 14,4 g Kierownik №30 Metoda równowagi elektronicznej Vikoristovuyuchi, złóż równą reakcję: Na 2 SO 3 + ... + KOH → K 2 MnO 4 + ... + H 2 O Vznachte okislyuvach i vіdnovnik. Mn +7 + 1e → Mn +6 │2 reakcja odnawiania S +4 − 2e → S +6 │1 reakcja utleniania Mn +7 (KMnO 4) - utleniacz, S +4 (Na 2 SO 3) - nośnik Na 2 SO 3 + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O Kierownik №31 Zalizo naprawiono gorącym stężonym kwasem siarkowym. Siła Otrimana została przedawkowana wodorotlenkiem sodu. Burzliwe oblężenie Vipav zostało przefiltrowane i usmażone. Przemówienie Otrimana było gorące z zimna. Napisz listę kilku opisów reakcji. 1) Zalizo, podobnie jak aluminium i chrom, nie reaguje ze stężonym kwasem siarkowym, zakrzywiając się z topnieniem tlenku tlenku. Reakcja zachodzi tylko po podgrzaniu z widzeniem kwaśnego gazu: 2Fe + 6H 2 SO 4 → Fe 2 (SO 4) 2 + 3SO 2 + 6H 2 O (po podgrzaniu) 2) Siarczan soli fizjologicznej (III) - rozpuszczalny w wodzie, wchodzi w reakcję wymiany z łąką, w wyniku czego wodorotlenek śliny (III) wpada w oblężenie (kolor półbrązowy): Fe 2 (SO 4) 3 + 3NaOH → 2Fe(OH) 3 ↓ + 3Na 2 SO 4 3) Nierozdzielone metale wodorotlenkowe po prażeniu rozkładają się na reaktywne tlenki i wodę: 2Fe(OH) 3 → Fe 2 O 3 + 3 H 2 O 4) Podczas ogrzewania tlenku (III) z solą metalu, tlenek soli (II) rozpuszcza się (ciało stałe w FeO może mieć pośredni etap utleniania): Fe 2 O 3 + Fe → 3FeO (po podgrzaniu) Kierownik №32 Napisz równe reakcje, za pomocą których możesz stworzyć taką transformację: W ciągu godziny pisania równych reakcji, vikoristovyte formuły strukturalne przemówień organicznych. 1) Odwodnienie wewnątrzcząsteczkowe zachodzi w temperaturze powyżej 140 o C. W rezultacie rozszczepienie atomu wody od atomu węgla do alkoholu wzrosło przez jeden do wodorotlenku alkoholu (w pozycji β). CH 3-CH 2-CH 2-OH → CH 2 \u003d CH-CH 3 + H 2 O (pranie - H 2 SO 4, 180 o C) Odwodnienie międzycząsteczkowe zachodzi w temperaturze poniżej 140 o C kwasem dwusiarkowym i prowadzi do rozszczepienia jednej cząsteczki wody na dwie cząsteczki alkoholu. 2) Do niesymetrycznych alkenów można dodać propylen. Gdy doda się halogenki wodoru i atom wody do atomu węgla w wiązaniu wielokrotnym, połączonym z dużą liczbą atomów w wodzie: CH2 \u003d CH-CH3 + HCl → CH3-CHCl-CH3 3) W wodnym roztworze NaOH dla 2-chloropropanu atom halogenu zastępuje się grupą hydroksylową: CH3-CHCl-CH3 + NaOH (aq.) → CH3-CHOH-CH3 + NaCl 4) Propylen można usunąć nie tylko z propanolu-1, ale także z propanolu-2 w reakcji odwodnienia wewnątrzcząsteczkowego w temperaturze powyżej 140 o C: CH 3 -CH (OH) -CH 3 → CH 2 \u003d CH-CH 3 + H 2 O (przemywanie H 2 SO 4, 180 o C) 5) W środowisku kałużowym, rozcieńczonym wodnym roztworem nadmanganianu potasu, obserwuje się hydroksylację alkenów zatwierdzonymi diolami: 3CH 2 \u003d CH-CH 3 + 2KMnO 4 + 4H 2 O → 3HOCH 2 -CH (OH) -CH 3 + 2MnO 2 + 2KOH Kierownik №33 Znaczące udziały masowe (%) soli siarczanu (II) i siarczku glinu w sumie, ale przy badaniu 25 g sumy z wodą, widoczny był gaz, który z większym prawdopodobieństwem przereagował z 960 g 5% siarczanu midi (II) . Należy zapisać równą liczbę reakcji, jakie są przypisane w zadaniach umysłowych, a następnie dodać niezbędne obliczenia (wskazać jednostki zmienności wielkości fizycznych, które żartują). Walidacja: ω(Al 2 S 3) = 40%; ω(CuSO 4) = 60% Podczas przetwarzania sumy siarczanu soli (II) i siarczku glinu wodą, siarczan jest po prostu oddzielany, a siarczek hydrolizowany wodorotlenkiem glinu (III) i wodą: Al 2 S 3 + 6 H 2 O → 2Al(OH) 3 ↓ + 3H 2 S (I) Podczas przepuszczania wody obiegowej przez siarczan midi (II), opady wypadają z siarczku midi (II): CuSO 4 + H 2 S → CuS ↓ + H 2 SO 4 (II) Obliczamy masę i ilość mowy mieszanego siarczanu midi(II): m (CuSO 4) \u003d m (p-ra) ω (CuSO 4) \u003d 960 g 0,05 \u003d 48 g; ν (CuSO 4) \u003d m (CuSO 4) / M (CuSO 4) \u003d 48 g / 160 g \u003d 0,3 mola Dla równych reakcji (II) ν (CuSO 4) \u003d ν (H 2 S) \u003d 0,3 mola, a dla równych reakcji (III) ν (Al 2 S 3) \u003d 1 / 3ν (H 2 S) \u003d 0, 1 mola Policzmy masy siarczku glinu i siarczanu midi(II): m(Al 2 S 3) \u003d 0,1 mol 150 g / mol \u003d 15 g; m(CuSO4) = 25 g - 15 g = 10 g ω (Al 2 S 3) \u003d 15 g / 25 g 100% \u003d 60%; ω (CuSO 4) \u003d 10 g / 25 g 100% \u003d 40% Kierownik №34 Kiedy spalyuvannі zrazka deyakoї organії ї pół masy 14,8 g pobrano 35,2 g dwutlenku węgla i 18,0 g wody. Najwyraźniej wpływ oparów mowy jest bardziej powszechny 37. W trakcie badań chemicznych właściwości mowy ustalono, że keton jest rozpuszczany w interakcji mowy z tlenkiem midi(II). Na podstawie tych danych zastanów się nad zadaniem: 1) oblicz liczby niezbędne do ustalenia wzoru cząsteczkowego mowy organicznej (wskaż jednostki zmienności wielkości fizycznych, które żartują); 2) zapisz wzór cząsteczkowy mowy organicznej; 3) zsumuj wzór strukturalny linii mowy, aby jednoznacznie odzwierciedlał kolejność połączeń atomów w pierwszej cząsteczce; 4) zapisz równą reakcję mowy z tlenkiem midi(II), wikorystyczną formułą strukturalną mowy. Ustala się wynik з мії nie niższy niż minimalna liczba kulek, dający prawo do wstąpienia na uniwersytety w specjalności, de przedmiot chemii. VNZ nie ma prawa ustalać minimalnego progu dla chemikaliów poniżej 36 punktów. Prestiżowe uczelnie z reguły ustalają swój minimalny próg bogactwa. Dlatego w celu nauki tam studenci pierwszego roku mogą mieć więcej dobrej wiedzy. Na oficjalnej stronie internetowej FIPI szeroko publikowane są opcje ED w chemii: demonstracja, okres przed udarem. Te same opcje dają stwierdzenie o strukturze przyszłego snu i poziomie składania dnia oraz є dzherelami wiarygodnych informacji podczas przygotowań do ЄДІ. W wariantach ЄDI z khіmії 2017 rok 2017 został zmieniony z KІM z minionego roku 2016, na który trzeba było przygotować się do obecnej wersji, a dla zróżnicowanego rozwoju absolwentów, opcje vikoristovuvat z ostatnich lat . Dodatkowe materiały i wyposażenie Do wersji skórnej robota badawczego ЄDI z chemiї dodano następujące materiały: − układ okresowy pierwiastków chemicznych D.I. Mendelew; − tablica soli, kwasów i zasad w wodzie; − elektrochemiczne szeregi napięć metali. W ramach godziny zaliczenia pracy egzaminacyjnej można przetestować kalkulator nieprogramistyczny. Przeniesienie dodatkowych dodatków i materiałów, które można wykonać w EDI, potwierdza rozporządzenie Ministerstwa Edukacji Rosji. Dla tych, którzy chcą kontynuować naukę na uczelni, wybór przedmiotów w maju, w zależności od wyboru testów wstępnych na wybraną specjalność Zmiana egzaminów wstępnych na uczelnie na wszystkie specjalności (szkolenie bezpośrednie) została wyznaczona rozporządzeniem Ministerstwa Edukacji i Nauki Ukrainy. Skórę większego zastawu początkowego wybieram z pierwszego przekazania tych i innych przedmiotów, co wskazuje, że przyjmę we własnych regułach. Należy zapoznać się z informacjami na stronach internetowych wybranych krajów, w pierwszej kolejności złożyć wniosek o udział w EDI z przeniesienia tych samych podmiotów.FORMUŁA MOWY
ODCZYNNIKI
Prestrokovy wersja ЄDI z khimiї 2017 rіk
Rik
Uzyskaj wariant pre-strunowy
2017
wariant po himi
2016
zdobyć przewagę
Wersja demonstracyjna ЄDI z khіmії 2017
Opcja zavdan + vіdpovіdі
Pobierz opcję demo
Specyfikacja
wariant demo himiya ege
Kodyfikator
kodyfikator
(Bezpośrednie przygotowanie).