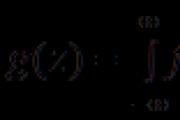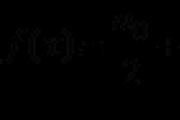Objętość niebieskich gazów w reakcjach chemicznych. Prawo Avogadro
Gazopodobny obóz mowy. Prawo Avogadro. Objętość molowa gazu.
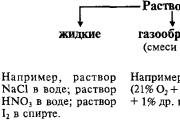
Mowa może być poddawana recyklingowi w trzech młynach kruszyw – stałych, rzadkich i gazowych. Cząstki w tej liczbie składają się z twardej mowy, aby zrobić między sobą mitzno pov'yazan, do tej twardej mowy tworzą jedną formę. Częściami ciał stałych mogą być atomy, cząsteczki, jony, które tworzą struktury krystaliczne. Qi chastki kolivayutsya z małą amplitudą pokonującą krystaliczny ґrat vuzlіv. W rodzimych regionach części są powiązane jeden do jednego słabiej i mogą być przesadnie ubrane, aby zrobić dużą różnicę. Z tego powodu pliniści i pęcznieją formy sędziów, w których smród jest znany.
Rzadko obserwuje się przejście mowy z ciała stałego podczas ogrzewania, w wyniku czego amplituda rozszczepienia cząstek stopniowo wzrasta. Gdy temperatura jest wysoka, cząsteczki mowy pęcznieją zdatnost, przytłaczają sęki zadziorów, obserwuje się topienie. Po schłodzeniu, navpaki, części rіdini spędzają ruch zdatnіst i naprawiają w pozycji śpiewania, czyniąc mowę mocną. Dla największych umysłów rіdini z reguły trudzi się życiem molekularnym. W wysokich temperaturach struktura rіdini może być inna (topienie soli i metali).
Oddziaływania między cząsteczkami bogato słabe, niższe między jonami w strukturach kryształów jonowych; atomy związane wiązaniem kowalencyjnym w strukturach atomowych; jony metali związane gazem elektronowym w konstrukcjach metalowych.
Mocny i rzadki obóz mowy, aby nadać śmiałe imię młyn kondensacyjny. Grubość mowy w skondensowanej stali zmienia się na granicach około 0,5 - 22,5 g/cm3. Mowa na stacji gazopodobnej może mieć znacznie mniejszą grubość - blisko 10 -2 - 10 -3 g/cm3. Przejście w młynie gazopodobnym jest spowodowane ogrzewaniem przemówień znajdujących się w młynie kondensacyjnym (wrzenie ciał stałych, sublimacja twardych przemówień). Gazopodobny dla największych umysłów mowy składa się z molekuł.
Przechodząc do stanu gazopodobnego, cząsteczki mowy dodają siły oddziaływania międzycząsteczkowego. Obsyag, który zajmuje gaz, w rzeczywistości zasłania wolną przestrzeń między cząsteczkami gazu, które losowo zapadają się. Wielkość tej przestrzeni zależy od temperatury i imadła. Kiedy obsyagom, zajęty przez same molekuły, możemy się zbuntować. gwiazdy krzyczą Prawo Avogadro :
Równe zaangażowanie różnych gazów ma tę samą liczbę cząsteczek dla tych samych umysłów.
z prawo krzyku Avogadro dwa główne ustalenia .
Pierwsza konsekwencja
Jeden kret dowolnego rodzaju gazu dla tych samych umysłów pożycza tę samą obietnicę. Tsey obsyag nazywa się molowe ciśnienie gazu ( V m ) , czyli vimiryuetsya wm 3 / mol (często w dm 3 / mol). Obowiązek molowy do gazu jest bardziej zaawansowany, aby zobowiązać gaz do tej samej kwoty:
Vіdomo, scho wartość V m, aby wpaść w umysły (temperatura, tysk). Do wykonania zadania konieczne jest zapamiętanie wartości V m at normalne umysły (n.o.s.) - ciśnienie atmosferyczne (101,3 kPa) i temperatura lodu (0 0 C lub 273,15 K).
Dla normalnych umysłów V m \u003d 22,4 dm 3 / mol lub
w jednostkach CI 0,0224 m 3 / mol.
Kolejna konsekwencja
Szerokości gazów (lub masy tych samych gazów) są zestawiane razem jako masy molowe gazów.
Widać to z takich luster. Przynieś dwie porcje różnych gazów o tym samym zobowiązaniu (obowiązki wimirian dla tych samych umysłów). Znamy ich:
Ustawienie їх masa:
Yakshcho vikoristovuvat schіlnіst:
Za prawem Avogadro n 1 \u003d n 2, patrz:
Zmianę grubości gazów, która jest droższa przy zmianie mas molowych, nazywa się nośność jednego gazu w drugim ( D ). D - wartość niezdefiniowana.
Znając D i masę molową jednego gazu, łatwo jest poznać masę molową innego gazu:
; M1 = M2 × D.
stosować
M(x) = M(H2) × D=2 × 8,5 = 17 g/mol
Gaz z takiej masy molowej - amoniak NH 3 .
Wykazano, że moc niektórych węglowodanów przypominających gazy jest droższa dla dwóch osób. Zmień swoją masę molową na węglowodany.
Średnia masa molowa wydaje się wynosić 29 g/mol.
M(x) = M(s.) × D=29 × 2 = 58 g/mol
Węglowodanem o takiej masie molowej jest butan Z 4 H 10 .
Zauważ, że gazy o masie molowej mniejszej niż 29 są łatwe na powtórzenie, więcej niż 29 jest ważnych.
W roślinach rozrahunkovyh mogą znajdować się dane dotyczące azotu, kwasowości i innych gazów. W tym przypadku dla wartości masy molowej należy pomnożyć lepką grubość przez masę molową, podobnie jak azot (28 g / mol), kwaśny (32 g / mol) itp.
Prawo Avogadro jest szeroko stosowane w badaniach chemicznych. Oskіlki dla gazów są proporcjonalne do liczby przemówień, a następnie współczynniki w równych reakcjach, które odzwierciedlają liczbę reagujących przemówień, proporcjonalnie do proporcji zakłócających się gazów. Oczywiście scho obsyagi mayut, ale vimiryan dla tych samych umysłów.
krupon
Do złuszczenia 2 dm potrzebny będzie jakiś rodzaj kwasku 3 propan? Vymiryan obyagi dla n. tak.
H3H8 + 5O2 3CO2 + 4H2O.
Z prawa Avogadro jasno wynika, że ta sama liczba różnych gazów powinna być równa tej samej liczbie cząsteczek i oczywiście tej samej liczbie moli mowy. Uzyskajmy propan do 1 dm3. Todi, z równej reakcji, do zaparzania 1 dm 3 propanu potrzebuje 5 dm 3 kwaśnego, a 2 dm 3 (dwa litry) - 10 dm 3 Pro 2.
Chemia
Globalna chemia
Podstawowe pojęcia, prawa i teorie chemii
Objętość niebieskich gazów w reakcjach chemicznych. Prawo Avogadro
Prawo pieniędzy Gay-Lussaca
Gazi reagują ze sobą na pieśni mowy ogólnej. W 1808 r. J.L. Gay-Lussaca, który ustanowił następującą zasadę: Ilość gazów, które wchodzą w reakcję można zobaczyć jeden do jednego z tych produktów gazopodobnych w reakcji, jako małe liczby.
Vіdkritiy vchenim prawo vіdomy w chemii jaka prawo wielkości b. W przypadku jogi konieczne jest, aby gazy biorące udział w reakcji były utrzymywane w tej samej temperaturze i ciśnieniu.
Vіdnoshennya obsyagіv gazіv, scho, aby wejść w reakcję chemiczną, vіdpovіdat równe współczynniki, na przykład: .
W tym przypadku 3 objętości wody reagują z 1 objętością azotu, w wyniku czego rozpuszczają się 2 objętości amoniaku, co pokazuje spontaniczność.
Menedżer. Jaka jest niezbędna reakcja wody dla 2 m 3 azotu?
Rozwiązanie
Z równej reakcji widać, że winna jest objętość wody, ale 3 razy większa za objętość azotu:
obsyag wody m3.
Prawo Avogadro
Aby wyjaśnić proste spіvvіdnoshenі mіzh vzyagyah reagujące gazy prawo vikoristovuyut Avogadro: Równe wiązania różnych gazów dla tych samych umysłów (temperatura i ciśnienie) mają tę samą liczbę cząsteczek.Nie pozwoliłem, żeby prawo Avogadro zapiszczało dwa razy ta:
1) Jeden mol dowolnego rodzaju gazu dla tych samych umysłów pożycza to samo zobowiązanie.
Dla normalnych umysłów (nie dotyczy), to w temperaturze 273 K i występku 101,3 kPa (1 atm) 1 mol dowolnego gazu zajmuje objętość równą 22,4 litra. Wezwanie Tsei obsyag gaz molowy ja oznacza l/mol.
Wiązanie molowe można rozluźnić za pomocą wzoru
.
2) Przy stałym ciśnieniu temperatura szczeliny gazowej jest mniejsza niż jedna masa molowa.
Tse pozwalają ci źle zrozumieć przepuszczalna grubość pierwszy gaz w inny sposób:
,
de D- widocznie schilnistowski, jak to widać, jednocześnie pierwszy gaz jest ważny dla drugiego dla tych samych umysłów.
Najczęściej vicorist jest w stanie zobaczyć wodę przez gaz. Todi:
; .
Możliwe jest rozluźnienie gęstego zarośla na dowolny gaz.
którego dystrybucja materiałów vikoristanu asystentka metodyczna„Navchannya rozvyazannyu problemy chemii”. Autorzy - administratorzy: nauczyciel chemii najwyższej kategorii, metodyk Instytutu Wychowania „Gimnazjum nr 1 miasta Grodna” Tolkach L.Ya.; metodyk oddziału początkowego-metodycznego Instytutu Edukacji „Grodno OIPK i PRR i SV” Korobova N.P.
Obliczanie liczby objętości molowych gazów.
Obliczanie wydatnego gąszczu gazów.
Objętość niebieskich gazów
Jeden kret dowolnego rodzaju gazu dla tych samych umysłów zajmuje ten sam. Tak więc dla normalnych umysłów (nie),Tobto. w temperaturze 0 °С i normalnym ciśnieniu atmosferycznym, które wynosi 101,3 kPa, jeden mol dowolnego gazu zajmuje objętość22,4 dm3.
UstawienieZobowiązuję gaz do pewnej chemicznej ilości mowy - wartości, jak to się nazywamolowe ciśnienie gazu (Vm):
Vm = V/ ndm 3, gwiazdkiV = Vm · n
Aby wybrać: najlżejszy lub najważniejszy gaz jest równy drugiemu gazowi, wystarczy wyrównać ich grubość:
r 1 / r 2 = M 1 V 1 / M 2 V 2 = M 1 / M 2 = D 2.Z punktu widzenia indukowanego virazu jest jasne: wyrównać szerokość gazów, osiągnąć wyrównanie ich mas molowych.
Stosunek masy molowej jednego gazu do masy molowej innego gazu to wartość, jak się to nazywa
dostrzegalna przestrzeń ( D 2 ) jeden gaz z innym gazem.Znając siłę jednego gazu w drugim, możesz obliczyć masę molową:
M
1 = M 2 · D 2 .Jeśli widzisz sumę gazów, to ta „masa molowa” jest równa masie o objętości 22,4 litra. Wartość Tsya jest liczbowo bardziej zaawansowana:
M pow. = 29 g/mol
Najwyraźniej, zgodnie z prawem Avogadro, ta sama liczba cząsteczek różnych gazów dla samych spokojnych umysłów zajmuje tę samą ilość.
Z tego wynika kolejna konsekwencja.
W stałych temperaturach i ciśnieniu gazy zaczynają reagować jeden do jednego, a także w zakresie produktów gazopodobnych, które osadzają się jak małe liczby.
Prawo to zostało sformułowane przez Gay-Lussaca jako prawo objętości gazów. W ten sposób, jeśli reakcja chemiczna ma swój udział lub wydobywa się mowa gazowa, to dla równych reakcji można zainstalować tomy niebieskiego.
Gazy Obsyagi, na które reagują, są proporcjonalne do ilości chemicznych tych przemówień:
V 1 / V 2 = n 1 / n 2 tobto. V1 i V2
liczbowo równe współczynniki równych reakcji.Przykład 1. Balon mieści 0,5 kg wyciśniętej wody. Jaka objętośćpożyczyć tak dużą ilość wody? zmyć normalna.
Rozwiązanie:
1. Oblicz ilość chemiczną
woda, co pomścić w balonie:N
(H 2) \u003d 500/2 \u003d 250 (mol), de M (H 2) \u003d 2 g / mol.2.Oskіlki dla normalnych umysłów 1 mol dowolnego gazu zajmuje łącznie 22,4
dm 3, toV = Vm · n, V( H 2 ) = 22,4 * 250 = 5600 (dm3)
Widpowid: 5600 dm 3
Tyłek2. Jaki magazyn (w %) stopu aluminium-mid, jak przy badaniu 1 g nadmiaru jodu kwasu solnego stwierdzono 1,18 l woda?
Rozwiązanie:
1. Wtedy tylko aluminium może wejść w reakcję z kwasemnapisz równe:
2A1 + 6HC1 = 2A1C1 3 + 3H 2
2mol 3mol
2. Obliczalne ilość chemiczna woda:
n(H 2 ) = 1,18/22,4 = 0,05 (mol)
3. Na podstawie reakcji obliczamy masę aluminium,co schować w stopie:
3 mol 2 mol aluminium
0,05 mola zobaczyć wodę, jakby zareagowaćxmol aluminium
x \u003d 0,05 2/3 \u003d 0,033 (mol),
m( Glin) = 0,035 27 = 0,9 (g), de M(Aja) = 27 g/mol
5. Obliczalne ułamek masowy aluminium w metalu:
w(ALEja) = m ( Glin ) / m (Stop) , w( A1) = 0,9/1 = 0,9 chi 90%.
Ułamek masowy Todi ze stopu midi 10%
Rodzaj: 90% aluminium, 10% midi
przykład 3. Wyraźnie rozpoznawalna siła: a) powtórzę to,b) woda z dwutlenkiem węgla.
Rozwiązanie:
1. Wiadomo, że gdy na to spojrzysz, zobaczysz kwaśność:
D povit (Pro 2) =M(Pro 2)/M (pow.) = 32/29= 1,1.
2. Możemy zobaczyć obecność dwutlenku węgla przez woda
D H2 (CO 2) =M(Z 2 )/M(H 2) \u003d 44/2 \u003d 22.
Widpowid: 1,1; 22
tyłek 4. Określ objętość gazów, które dodają do 0,5 mola kwaśnego, 0,5 mola wodyi 0,5 mola dwutlenku węgla.
Rozwiązanie:
1. Znamy ilość chemiczną sumy gazów:
n(podsumowanie) \u003d 0,5 + 0,5 + 0,5 \u003d 1,5 (mol).
2. Oblicz całkowitą ilość gazów:
V(podsumowanie) \u003d 22,4 1,5 \u003d 33,6 (dm 3).
Szerokość: 33,6 dm 3 sumy
Przykład 5. Oblicz objętość dwutlenku węgla emitowanego podczas plucia 11,2 m 3 metan CH 4 .
Rozwiązanie:
1. Zapisz reakcję chemiczną spalania metanu:
CH4 + 2O2 \u003d CO2 + 2H2O
1 kret1 kret
1m3 1m3
2. Aby obliczyć ilość dwutlenku węgla, sumujemy i zmieniamy proporcje:
podczas spania 1 m 3 CH 4 weide 1 m 3 2
podczas snu 11,2 m 3 CH 4 viide x m 3 2
x \u003d 11,2 1/1 \u003d 11,2 (m 3)
Vidpovid: 11,2 m 3 dwutlenek węgla
Przykład 6. Stalowy cylinder do zbierania sprężonych gazów został wypełniony rzadką kwaśną masą 8 kg.
Jaki obsyag pożyczył gaz ze stacji benzynowej (n.o.)?
Rozwiązanie:
1. Oblicz ilość chemiczną rzadkiego kwaśnego:
n( O 2 ) = 8000/32 = 250 (mol).
2. Obliczanie kwasu gazopodobnego:
V( O 2 ) \u003d 22, 4 250 \u003d 5600 dm 3.
Widpowid: 5600 dm 3
Przykład 7. Oblicz masę o objętości 1 m 3 (n.o.), czyli 78 objętości azotu, 21 - kwaśny, 1 - argon (krym innych gazów).
Rozwiązanie:
1. Vyhodyachi z zavdannya, obsyagi gazіv vіtrі vіdpovіdno dorovnyuyut:
V( N 2 ) \u003d 1 0,78 \u003d 0,78 m 3;
V(Pro 2) \u003d 1 0,21 \u003d 0,21 m 3
V(ALEr) \u003d 1 0,01 \u003d 0,01 m 3.
2. Oblicz chemiczną ilość gazu w skórze:
n( N 2 ) \u003d 0,78 / 22,4 10 -3 \u003d 34,8 (mol),
n(Pro 2) \u003d 0,21 / 22,4 10 -3 \u003d 9,4 (mol),
n(ALEr) \u003d 0,01 / 22,4 10 -3 \u003d 0,45 (mol).
3. Oblicz masę gazów:
m(N 2 ) = 34,8 28 = 974 (g),
m(Zawodowiec 2 ) = 9,4 32 = 30 (g),
m(ALEr) = 0,45 40 = 18 (d).
4. Oblicz masę za każdym razem:
m(Powtórz) \u003d 974 + 301 + 18 \u003d 1293 (g) lub 1,293 kg.
Waga: 1,293 kg dziennie
Przykład 8. Kiedy podpalyuvanni w evdiometrі sumuje kwaśną i wodę o objętości 0,1 m 3 całkowita suma zmieniona o 0,09 m 3 .
Yaki obiecujewoda i kwaśne były na wyjściu sumishi, jak gaz, co zostało, płonąc (n.o.)?
Rozwiązanie:
1. Zapisz równą reakcję:
2H 2 + Zawodowiec 2 = 2H 2 Zawodowiec
2 mola 1 mol 2mol
2. Oczywiste jest, że gazy, które weszły w reakcję.
zaangażowany worek gazowy rzucił się na rahunka świeżej wody, do której gazy wchodzące w reakcję osiągnęły 0,09 m 3 .
Ponieważ gazi wejść w reakcję z szybkością 2:1, a następnie od 0,09 m 3 dwie części
spaść na wodę, a jeden - na pocałunek. Ojcze, miej reakcję
wszedł 0,06 m 3 woda i 0,03 m² 3 kwaśny.
3. Oblicz ilość gazu w całkowitej ilości.
Ponieważ gaz, jeśli się przelewa, pali, to cały dzień 0,01 m 3 .
V(H 2 ) = 0,01 + 0,06 = 0,07 (m 3 ) lub 70 l,
V(Zawodowiec 2 ) = 0,1 - 0,07 = 0,03 (m 3 ) lub 30 l.
Sugestia: 70 litrów wody, 30 litrów kwaśnej
Przykład 9. Jaka jest różnica między ilością wody w mieszaninie gazów, którą dodaje się do 56 litrów argonu i 28 litrów azotu (n.o.)?
Rozwiązanie:
1. Vyhodyachi z vyznachennya vіdnoї gustina gazіv,
D H 2 = M (zwariowany) / M(H 2 ).
2. Oblicz ilość chemiczną i wagę sumy gazów:
n(Ar) = 5,6/22,4 = 2,5 (mol);
n(N 2 ) = 28/22,4 = 1,25 (mol);
n(podsumowanie) \u003d 2,5 + 1,25 \u003d 3,75 (mol).
m(Ar) = 2,5 40 = 100 (g),
m(N 2 ) = 1,25 28 = 35 (g),
m(podsumowanie) \u003d 100 + 35 \u003d 135 (g), ponieważ
MAMAr) = 40 g/mol, M (N 2 ) = 28 g/mol.
3. Oblicz sumę masy molowej:
M(sumowanie) = m (zwariowany) / n (zwariowany) ;
M (podsumowanie) \u003d 135 / 3,75 \u003d 36 (g / mol)
4. Oblicz całkowitą ilość gazu w wodzie:
D H 2 = 36/2 = 18.
Data: 18
tyłek 10. Czy można spalić 3 g drewnianego vugill na trzylitrowym bantz, wypełnionym kwaśnym (n.o.)?
Rozwiązanie:
1. Zapisz równą reakcję górskiego vugilla:
W + Zawodowiec 2 = WIĘC 2
1 mol 1 mol
2. Oblicz ilość chemiczną vugill:
n(Z) = 3/12 = 0,25 (mol), więc M (C) \u003d 12 g / mol.
Niezbędna do reakcji chemiczna ilość kwasu będzie również równa 0,25 mola
3. Oblicz ilość kwasu potrzebnego do wykruszenia 3 g wódki:
V(O 2 ) = 0,25 22,4 = 5,6(l).
4. Gaz Oskіlki pożycza objętość naczynia, w tym samym winie, które jest znane, є 3 litry kwasu. Otzhe, nie zszywaj kilkos dla spalyuvannya 3 g vugillya.
Wskazówka: nie zszywaj
tyłek 11. Ile razy zwiększyć objętość rzadkich wód w przyszłości przemiany w parę w n.s.?
Do reakcji chemicznych aA + bB = cC + dD
budzenie
de nA i nB to liczba wolnych wypowiedzi, które zareagowały, ps i nD to liczba produktów, które uległy rozpuszczeniu, a, b, c i d to współczynniki stechiometryczne.
Z liczby przemówień łatwo przejść na mszę :
W przypadku przemówień przypominających gaz, częściej ustawia się chi, aby oznaczało ich obowiązki. Jeśli odczynnik i produkt D są gazami, przeprowadź przejście od liczby kości tych przemówień do ich:
![]()
W przypadku ilości vіdomih (na umysł), masi lub oblige (dla gazu) jednego z przemówień, które biorą udział w reakcji, można wywnioskować wartości wszystkich ilości dla innych przemówień.
Przy różnych sumach gazów A i B, z których jeden bierze udział w reakcji, można poznać sp_v_dnoshnenja їkh obsyagіv VA: VB, a dla danego sp_vv_dnoshnі - їkh obsyag sumіshi (lub navpaki).
Butt rozvyazannya zadania
W wysokiej temperaturze magnez reaguje z azotem, spójrzmy na sumę argonu o łącznej objętości 5,6 l (n.o.) i dodajmy 15 g azotku. Oblicz objętość gazów V(N2): V(Ar) na sumie wyjściowej.


Zadanie dla niezależne rozwiązanie część A
1. 6 l tlenku azotu (II) przereagowało z 5 l kwasu
2. W zamkniętym naczyniu spalono 24 g grafitu w 67,2 l (b.d.) kwaśnej substancji i usunięto objętość kwaśnej: produkt jest równy
3. Przez ozonator przeszło 7,5 mola kwaśnego, który często zamieniał się w ozon. Pozostało po barwieniu do „zasolenia” (dla normalnych umysłów) 0,5 mola wody z krwi (powrót do SO2); później objętość O3:O2 na wyjściu z ozonatora wzrosła
4. Bromek potasu o masie 142,8 g, po niewielkiej reakcji z chlorem, przyjmiemy go w tej samej ilości powtórzeń w stosunku objętościowym 1 (chlor): 2 (powtórz). Galny obsyag (w litrach)
5. Do całkowitego spalenia 17,92 l (n.o.) sumish CH4 + H2 potrzebny był 1 mol kwasu. Pod koniec dnia całkowita ilość CH4:H2 jest bardziej wyraźna:
6. Gaz A podczas prażenia 0,04 mola KClO3 na katalizatorze zdjęliśmy (nie dotyczy) naczynie z gazem B, co zaobserwowano przy badaniu 6 g wapnia z wodą i odjęliśmy sumę objętości A: B , równe
7. Po wypluciu nitrobenzenu w nadmiarze kwasowości sumy produktów (azot, dwutlenek węgla, woda), w których usuwa się 4 litry (n.d.) azotu, a objętość N2:O2 jest większa niż 4: 1. w litrach , n . u.) staje się kwaśny
8. Prowadzony rozkład termiczny 1 mola chlorku amonu w stalowym balonie, który zawierał również 11,2 l (b.d.) amoniaku. Kіntseve ob'єmne vіdnoshennia NH3: НCl dorovnyuє
9. Sumish kwaśny i chlorowy o objętości 9:1 wikoristan za zobaczenie 0,5 mola prostej mowy o zakresie KI
10. Kissen przepuszczono przez ozonator, gdy 1 mol KClO3 został prażony na katalizatorze, gdy prażyło się 5% kwasowości, kwas zamienił się w ozon i na wyjściu z ozonatora zmniejszyła się objętość O2:O3
Fizykochemiczne prawidłowości formowania cienkotopionych układów metal-polimer z fazy gazowej
Cienkotopione materiały metalowo-polimerowe (polimery metalu, płyty metalowe z cienkimi powłokami polimerowymi, bogate systemy kulkowe itp.), które są formowane w technologii próżniowej.
Wzrost epitaksjalny Ge na powierzchniach Si(100)
Z fizyki cienkich plam można sięgnąć perspektyw dalszego rozwoju mikroelektroniki, optyki i innych zastosowań nowych technologii. Sukcesy mikrowydobycia elektroniki...
Komponenty, które mogą być mocne i zmniejszać palność materiałów polimerowych
Niedługo później gospodarka kraju zostanie uratowana od setek milionów rubli. Podczas spalania materiałów polimerowych widać to duża liczba toksyczne gazy, które są szkodliwe dla ludzi i ...
Cele lekcji:
Recenzja zamiast dokumentu
„Klasa chemii 9 Objętości niebieskich gazów w reakcjach chemicznych. Obliczanie całkowitego zużycia gazów dla równości chemicznych.
Lekcja chemii na temat „Objętość niebieskich gazów w reakcjach chemicznych. Obliczanie całkowitego zużycia gazów dla równości chemicznej”
Lekcja nr 3 na temat techniki krytycznego myślenia
Cele lekcji: wykształcić wiedzę o prawie objętości wody dla mowy gazopodobnej na podstawie reakcji chemicznych mowy organicznej; tworzą prawo o'mnih spіvvіdnoshen dla rozrahunkіv іz khіmіchnyh rivnyan. Dodoskonaljuvati vminnya uchnіv virіshuvati rozrakhunkovі zavdannya shdo rіvnyan khіmіchnih reaktsіy. Rozwijaj magazyn vmіnnya uchnіv khіmіchі zavdannya. Rozwijaj krytyczne myśli. Tworzą pozytywne otoczenie, dopóki obiekt nie zostanie ukończony, podsumowanie otoczenia przed zakończeniem zadania.
Własność: karty zadań.
Ukryj lekcję.
I.Rozgrzewka(Uczniowie gubią się w swoich myślach)
A. Frans „Jeśli ktoś myśli, nie będzie sumniv, ale nie będzie zachwycony, jeśli…”
Jak skończyłeś to zdanie?
Naucz się ćwiczyć w grupach. Zapisz proponowane opcje. Wybierz tі, yakі na їhnyu dumku pasuje więcej.
Visnovok: „Jeśli ktoś myśli, nie będzie zdezorientowany, ale nie będzie śpiewany, jeśli tak jest”.
Spodіvayus, scho po prawej, którym jesteśmy zajęci na lekcji, aby cię uderzyć, a pokażesz swoją energię w teraźniejszości.
II. Motywacja do nauki.
Oszołomiony przez tych, którzy prowadzą lekcję.
S. Aktualizuj kroki
Za diagramem V_den odgadnij moc chemiczną alkenіv i alkіnіv.
Dlaczego się przejmujesz skurcz trzonowy jakikolwiek gaz dla n.s.
Sugestia: 22,4 l/mol
Jak sformułowane jest prawo Avogadro?
Sugestia: Przy tych samych obowiązkach różnych gazów, dla tych samych umysłów (t, p) mści się ta sama liczba cząsteczek.
Visnovok: Ilości gazopodobnych odczynników i produktów reakcji są skoordynowane, gdy ich współczynniki w reakcji są sobie równe. Tsya zakonіrnіst vikoristovuєtsya dla khіmіchnyh rozrahunkіv.
Zadanie twórcze:(Daje możliwość ponownego przemyślenia z dużą wiedzą naukowców na ten temat)
W trzech ponumerowanych tubach, zamkniętych korkami, є: metan, etylen, acetylen. Jak rozpoznać, gdzie ma być poznany gaz?
IV. Kroki powiadomienia(Doprowadzenie do znajomości materiału opartego na problemach, poszukiwanie prawdy).
Wykład („Karuzela” został wzmocniony: podstawowe zrozumienie tego, jak dzień ślubu jest podawany na początku; po zakończeniu uczniowie jednoczą się w zakładzie, wygrywają podobne zadania; układają podobne zadania, jak dzień sądu itp. .)
Objętość chloru (n.o.) do przereagowania z 7 litrami propenu wynosi:
a) 14 l; b) 10 l; c) 7 l; d) 22,4 litra.
3. Oblicz całkowitą sumę pieniędzy potrzebną na spalling sumishi,
dodaje do 5 l etylenu i 7 l acetylenu (n.o.).
Proszę wskazać, jaka objętość wody jest potrzebna do całkowitej hydrolizy 7 litrów etylenu, aż do uzyskania równej odczynu:
Z 2 H 4 + H 2 \u003d Z 2 H 6 a) 7 l; b) 6 l; c) 14 l; d) 3,5 litra.
Pary pracują. Uczniowie, zjednoczeni w zakładzie, układają podobne zamówienia, jak para virishu sudidnya:
Objętość wody potrzebna do pełnego podlewania to 15 litrów butiny, więcej: a) 15 litrów; b) 30 l; c) 7,5 l; d) 3,5 litra.
Dowolną objętość chloru dodaje się do 5 l acetylenu, w zależności od reakcji C 2 H 2 + 2Cl 2 \u003d C 2 H 2 Cl 2
a) 5 l; b) 10 l; c) 2,5 l; d) 22,4 litra.
3. Oblicz całkowity koszt, ponieważ trzeba przeznaczyć na oszczędzanie
10 m3 acetylenu (NO).
V. Odbicie
Zadanie Vikonannya z karty.
Oblicz całkowitą ilość wody, potrzebę wielokrotnego podlewania mowy X.
(Ucz się samodzielnie wypełniać tabelę, po zakończeniu pracy odpowiedzą na pytania).
| Obsyag mowa X, l | Formuła mowy X | Rivnyannya gidrovannya | woda, ja |
|
VІ . Visnovki z lekcji
Sformułowano zadanie nadchodzącej lekcji.
VІ I. Woreczki na lekcję
VIII. Zadanie domowe
Propratsiuvati paragraf 23, vikonati prawo 206, 207 z boku.