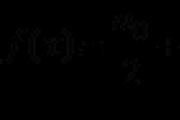Oddziaływanie pierwiastków chemicznych. „Oddziaływanie atomów w pierwiastkach-niemetalach między sobą” (klasa 8)
Cele lekcji:
- Dowiedz się o różnych rodzajach wiązań chemicznych.
- Powtórz schematy wygłaszania przemówień z innym rodzajem połączenia. Kontynuuj kształtowanie i zapisuj je na zapasach.
- Porivnyati różne rodzaje zv'azku.
Zadanie lekcyjne:
- Zamknij zrozumienie elektroujemności pierwiastki chemiczne, widząc wiązanie kowalencyjne: polarne i niepolarne;
- Poprawić w myślach składanie elektronicznych wzorów strukturalnych, wyjaśniających mechanizm powstawania wiązań kowalencyjnych; vikoristovuvaty nabutі znannya że vmіnnya praktіyіy dіyalnostі;
- Przyjmij rozwój komunikatywnych umysłów;
- Rozwijaj logiczne myśli.
Podstawowe warunki:
- Metale - wszystkie pierwiastki chemiczne, których atomy łatwo wydzielają własne elektrony, przekształcając się w jony dodatnie.
- Nemetali - te same pierwiastki chemiczne, których atomy otrzymują elektrony na normalnym poziomie, przekształcając się w jony ujemne
- oni - naładowane są cząstki, na których następuje transformacja atomu po dostarczeniu lub przyjęciu elektronów.
- Elektroujemność - wartość budynku atom pierwiastek chemiczny do przyciągania elektronów innego atomu.
- Dźwięk chemiczny
- metoda interakcji atomów, która prowadzi do powstania cząsteczek.
UKRYTA LEKCJA
Oddziaływanie atomów między pierwiastkami i niemetalami
Po raz pierwszy zgadnijmy, jak wygląda układ okresowy pierwiastków i jest w nim widoczny metal, niemetal, metaloid. Pomóż nam z rysunkiem 1.
Mal. 1. Układ okresowy pierwiastków
Złowieszcza kula atomów niemetali powinna zostać pomszczona od 4 do 8 elektronów.
Vignatok: H (1e); Chi nie (2e); (3e)
Promień atomów niemetali jest mniejszy niż promień atomów metali.
Pierwiastki chemiczne nie są wrzucane z układu okresowego na kolby podgrup głów, począwszy od grupy trzeciej i ostatnich okresów, tobto. w prawej górnej części układu okresowego. Dziecko 2.
Mal. 2. Oztashuvannya niemetali w układzie okresowym
Moc chemiczna niemetali
Pierwiastki chemiczne-nie-miotacze mogą działać jak utleniacze, więc dają moc, wpadają w przemianę chemiczną, w której smród przyjmuje swój los.
Atomy najbardziej elektroujemnego pierwiastka - fluoru - nie dają elektronów, zawsze wykazują tylko moc utleniania, inne pierwiastki mogą wykazywać i dawać moc, nawet bogatszy w świecie, niższy metal. Najpotężniejszymi utleniaczami są fluor, paliwo tlenowe i chlor, przede wszystkim woda, bir, węgiel, krzem, fosfor, mish'yak i telur. Promіzhnі okislyuvalno-vіdnovі vіdnovі vіdnovnі vіdnovі vіlіvі vіstі vіtіt azot, іrka, jod.
Interakcja z prostymi przemówieniami
1. Interakcja z metalami:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
w tych drganiach niemetale wykazują zdolność utleniania, śmierdzi otrzymują elektrony, co powoduje, że cząstki są naładowane ujemnie.
Na filmie możemy przyjrzeć się wzajemnemu oddziaływaniu sodu z chlorem
2. Interakcja z innymi niemetalami:
w połączeniu z wodą, większość niemetali wykazuje zdolność utleniania, zadowalając wodorki wodno-półkowalencyjne:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
vzaimodiyuchi z kwaśnym, wszystkie nie rzucane, kremowe do fluoru, wykazują wpływowy autorytet:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
podczas interakcji z fluorem fluor utlenia się, a kisen jest przewodnikiem:
2F2 + O2 = 2OF2;
niemetale oddziałują ze sobą, więcej metalu elektroujemnego pełni rolę środka utleniającego, mniej metalu elektroujemnego pełni rolę nośnika:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.
Spójrz na kowalencyjne połączenia polarne i niepolarne na najmłodszych. Przynieś niedopałki żywiołów, jak dawanie ich maluchom.
Mal. 3.
Mal. 4. Kowalencyjne połączenie niepolarne
Na wideo 2 możesz obejrzeć i posłuchać kowalencyjnego połączenia niepolarnego
Przedmioty > Chemia > Klasa chemii 8przyjemny
Zasady rejestracji koristuvachs na stronie „ZNAK JAKOSTI”:
Rejestracja koristuvachs podobnych do nich jest blokowana: 111111, 123456, yutsukenb, lox і.t.p;
Obroniona przez ponowną rejestrację w serwisie (utworzenie podwójnego konta);
Ochrona danych innych osób;
zaboronyaetsya vikoristovuvat adresy e-mail innych osób;
Zasady postępowania na stronie, forach oraz w komentarzach:
1.2. Publikacja w ankiecie specjalnych danych dla innych studentów z krótkiej listy.
1.3. Czy jest to destrukcyjne dla tego zasobu (niszczące skrypty, odzyskiwanie hasła, uszkodzenie systemu bezpieczeństwa).
1.4. Vikoristannya jako przydomek nieprzyzwoitych słów i viraziv; vislovіv, jak łamanie prawa Federacja Rosyjska, normy etyki i moralności; słowa i wyrażenia podobne do pseudonimów administratorów i moderatorów.
4. Szkody II kategorii: karalne nowym ogrodzeniem na administracji, czy są jakieś rodzaje zbrojenia na liniach do 7 deb. 4.1 Rozpowszechnianie informacji podlegających przepisom Kodeksu karnego Federacji Rosyjskiej, Kodeksu administracyjnego Federacji Rosyjskiej i Konstytucji Federacji Rosyjskiej.
4.2. Propaganda w jakiejkolwiek formie ekstremizmu, przemocy, okrucieństwa, faszyzmu, nazizmu, terroryzmu, rasizmu; rozpalyuvannya międzyetniczny, międzyreligijny i społeczny vorozhnech.
4.3. Nieprawidłowo omówione prace i obrazy pod adresem autorów tekstów i notatek publikowanych na stronach „ZNAKU JAKOSTIEGO”.
4.4. Zagrożenie pod adresem uczestników forum.
4.5. Rozpowszechnianie nieprawdziwych informacji, szkalowanie innych oświadczeń oczerniających honor i godność zarówno coristuvachi, jak i innych ludzi.
4.6. Pornografia w awatarach, cytatach i cytatach, a także publikowanie na obrazach i zasobach pornograficznych.
4.7. Otwórz dyskusję między administratorami a moderatorami.
4.8. Publiczna dyskusja na temat oceny oficjalnych przepisów w jakiejkolwiek formie.
5.1. Zwalcz tę wulgaryzmy.
5.2. Prowokacje (specjalne vipadi, specjalna dyskredytacja, powstawanie negatywnych reakcji emocjonalnych) i dyskusja uczestników (systematycznie zwycięskie prowokacje stu pięćdziesięciu uczestników).
5.3. Prowokowanie koristuvachiv do konfliktu jeden po drugim.
5.4. Niegrzeczność i chamstwo w zakresie wychowywania spivrozmovniki.
5.5. Przejście do osób fizycznych i z'yasuvannya osobistih vіdnosin na forum.
5.6. Powódź (informacje identyczne lub niezdiagnozowane).
5.7. Navmisne błędnie przeliterowało pseudonimy i nazwy innych coristuvachs w formach przenośnych.
5.8. Cytaty Redaguvannya voіdomlen, scho soporuє їkh zmіst.
5.9. Publikacja specjalnej listy bez wyraźnego wyrażania ducha szpiega.
5.11. Trolling destrukcyjny - cel przekształcenia rozmowy w potyczkę.
6.1. Przypomnienie o zawyżonym (nadmiernym cytowaniu).
6.2. Czcionka Vicoristannya w kolorze czerwonym, uznana za koriguvannya i szacunek dla moderatorów.
6.3. Kontynuacja dyskusji na tematy zamknięte przez moderatora i administratora.
6.4. Tworzone przez tych, którzy nie noszą semantycznego nacisku, ale prowokują ze względu na to.
6.5. Tworzenie nagłówka tematami lub tymi samymi literami, często wielkimi literami lub przez mój obcy. Vinyatok, aby walczyć o nagłówki publikowanych tematów i tematów, które zostały zatwierdzone przez moderatorów.
6.6. Utwórz podpis w większej czcionce, obniż czcionkę posta i odejmij podpis w więcej niż jednym kolorze palety.
7. Sankcje, yakі zastosovuyutsya dla naruszających Regulamin Forum
7.1. Timchasova lub zamieść ogrodzenie w sprawie dostępu do Forum.
7.4. Widok rekordu oblіkovogo.
7.5. Blokowanie adresów IP.
8. Uwagi
8.1 Sankcje ze strony moderatorów i administracji mogą być stosowane bez wyjaśnienia.
8.2. W niniejszym regulaminie można dokonać zmian, które zostaną zgłoszone wszystkim uczestnikom serwisu.
8.3. Coristuvachas są okupowane przez klony vicorist w okresie jednej godziny, jeśli główny pseudonim jest zablokowany. W ten sposób klon jest blokowany bez linii, a główny usuwa dodatkową dobę.
8.4 Ostrzeżenia o nieprzyzwoitym języku mogą być edytowane przez moderatora lub administratora.
9. Administracja Administracja strony "ZNAK YAKOSTY" zastrzega sobie prawo do otrzymywania wszelkich informacji bez wyjaśnienia. Administracja serwisu zachowuje prawo do edycji profilu korespondenta, gdyż informacje w nim zawarte często łamią regulamin forum. Szczegóły są rozszerzone dla moderatorów i administratorów. Administracja zastrzega sobie prawo do zmiany lub uzupełnienia Regulaminu w razie potrzeby. Nieznajomość zasad nie wystarcza do korupcji. Administracja serwisu nie jest w stanie przeglądać wszystkich informacji, tak jakby publikowała treść. Wszystkie opinie odzwierciedlają tylko myśl autora, ale nie mogą nie być wikoristanem, aby błyskawicznie ocenić myśli wszystkich uczestników forum. Informowanie strony spіvrobіtnikіv i moderatorów є viraz їhnої specjalnych myśli i nie może bać się redakcji i strony kerіvnitstva.
I. Klasyfikacja wiązań chemicznych
1. Za mechanizmem tworzenia wiązania chemicznego
a) Wymieniać się jeśli szkodzi atomom, które tworzą połączenie, daj mu za to niesparowane elektrony.
Na przykład roztwór cząsteczek wody H2 i chloru Cl2:
b) dawca-akceptor jeśli jeden z atomów jest gotowy do połączenia, przygotuję parę elektronów (donor), a drugi atom opróżni pusty orbital.
Na przykład jon amonowy (NH4) + (część naładowana):
2. Za metodą zginania orbitali elektronicznych
a) σ - zv'azok (sigma) jeśli maksymalne nakładanie leży na linii, to środek atomów jest z tyłu.
Na przykład,
H2 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
b) π - zvyazku (nі) tak, aby maksymalne nakładanie się nie leżało na linii, która znajduje się za środkiem atomów.
3. Za drogą do osiągnięcia gotowej powłoki elektronicznej
Skóra atomu nie jest w stanie dopełnić swojej nowej powłoki elektronicznej, a środków na osiągnięcie takiego celu może być niewiele.
|
Znak wyrównania |
kowalencyjny |
Ionna |
Metalewa |
|
|
niepolarny |
polarny |
|||
|
Jak można uzupełnić powłokę elektroniczną? |
Sklep z elektroniką |
Sklep z elektroniką |
Przenoszenie elektronów, przyjmowanie jonów (naładowanych cząstek) to coś nowego. |
Uzagalnennya elektronіv usіma atomy w Chrystusie. ghratah |
|
Jak wziąć los atomów? |
nime - nime EO = EO |
1) Nemet-Nemet1 2) Met-nimet EO< ЭО |
spełnione + [Nimet] - EO<< ЭО |
Węzły mają kationy i atomy metalu. Rozmowa może swobodnie poruszać się w przestrzeni międzywęzłowej elektroniki. |
|
∆c= EO1 - EO2 |
< 1,7 |
> 1,7 |
||
|
Zastosować |
tylko przemówienia - nie rzucane. |
kwasy, tlenki |
sole, łąki, kałużowe tlenki metali |
tylko przemówienia - metal. Zv'yazok w metalach i stopach, który wibruje słyszalnie silne elektrony między jonami metali w kryształach metali. |
II. Esencja wiązania kowalencyjnego
Łącznik kowalencyjny - tse link'yazyk, scho vinikaє mіzh atomy dla par elektronów rahunnya zagalnyh (na przykład H2, HCl, H2O, O2).
Za etapem przemieszczenia par elektronów o wysokim tonie do jednego z połączonych przez nie atomów, wiązania kowalencyjne mogą być polarnyі niepolarny.
III. Kowalencyjne niepolarne wiązanie chemiczne
Wiązanie kowalencyjne niepolarne (CNS) - utvoryuyut atomy jednego i tego samego pierwiastka chemicznego - niemetalu(Na przykład H2, O2, O3).
Mechanizm komunikacji
Atom skóry niemetalu jest widoczny w głębokiej skorupie drugiego atomu zewnętrznej pary elektronów. Zakłady online są rozstrzygane. Para elektronów jest taka sama dla obu atomów.
Przyjrzyjmy się mechanizmowi rozpuszczania cząsteczki chloru: Cl2- kn.
Schemat elektroniczny rozpuszczania cząsteczki Cl2:
Wzór strukturalny cząsteczki Cl2:
Cl - Cl, σ (p - p) - pojedyncze ogniwo
Demonstracja rozpuszczonej cząsteczki wody
Przyjrzyjmy się mechanizmowi powstawania kwaśnej cząsteczki: O2 - kn.
Elektroniczny schemat eliminacji cząsteczki O2:
Wzór strukturalny cząsteczki O2:
O = O
π
Cząsteczka ma wielokrotne, podfałdowane ogniwo:
Jeden σ (p - p)
ten jeden π (p - p)
Wykazanie rozpuszczalności cząsteczek tlenu i azotu
IV. Zavdannya do mocowania
Zavdannya nr 1. Poznaj wiązania chemiczne w cząsteczkach wygłaszanych przemówień:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Zadanie 2. Napisz mechanizm rozpuszczania się cząsteczek H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2. W przypadku wiązania kowalencyjnego określa się rodzaj nakładania się elektronów (π lub σ), a także mechanizm tworzenia (wymiana lub dawca-akceptor)
Przyjrzeliśmy się już, w jaki sposób atomy pierwiastków-metali oddziałują z atomami pierwiastków-niemetali: niektórzy dają własne elektrony i przekształcają się ze sobą na jonach dodatnich, inni akceptują elektrony i przekształcają się z innymi na jonach ujemnych. Są przyciągane jeden do jednego, zaspokajając połowę jonu.
A jak rozwija się związek między atomami pierwiastków-niemetali, jak mogę podążać za trendem przed nadejściem elektronów? Spójrz na tył, jak połączenie między atomami tego samego pierwiastka chemicznego, na przykład w mowie, gdzie można znaleźć cząsteczki dwuatomowe: azot N 2, woda H 2, chlor C1 2.
Szanuj, że w celu ulepszenia magazynu tych przemówień za pomocą znaków chemicznych istnieje również wskaźnik zastępczy.
Dwa identyczne atomy pierwiastka niemetalicznego mogą łączyć się w cząsteczkę tylko w jeden sposób: łącząc własne elektrony, dzięki czemu są wspólne dla obu atomów.
Spójrzmy na przykład na roztwór cząsteczki fluoru F2.
Fluor atomowy jest elementem głównej podgrupy grupy VII (grupa VIIA) układu okresowego pierwiastków chemicznych D.I. Mendeliew - trudzi się na poziomie energii równym temu elektronowi, a atom skóry nie dochodzi do końca tylko jednego elektronu. Zewnętrzne elektrony atomu fluoru spełniają trzy parytety elektronowe i jeden niesparowany elektron:
Gdy tylko dwa atomy zbliżą się do siebie, a w ich skórze - jeden po drugim niesparowany elektron, wówczas elektrony qi "łączą się" i stają się jasne dla obu atomów, w których powstają zakończenia zewnętrznego rzędu ośmiu elektronów.
Roztwór cząsteczki fluoru pokazano na schemacie:

Jak oznaczyć parę elektronów za pomocą ryżu, zapisz to jako wzór strukturalny, na przykład wzór strukturalny cząsteczki fluoru
Podobnie jak cząsteczka fluoru, dwuatomowa cząsteczka wody H2 rozpuszcza się:

Następnie zakończmy atom wody będzie linią dwuelektronową, podobną do ukończonej linii atomu helu.
Wzór strukturalny cząsteczki wody
![]()
Wyjaśnijmy nasze ustalenia dotyczące wiązania kowalencyjnego na podstawie rozpuszczonej cząsteczki wody, wikorystycznego rozumienia elektronicznego mroku (rozdział § 9). Kiedy dwa atomy znajdują się blisko siebie, które mają kulisty kształt, jedna chmura s-elektronów nałoży się na chmurę elektronów. Kiedy obwiniasz obszar (misce), w którym ładunek ujemny jest najwyższy, a zatem ładunek ujemny może się poruszać. Dodatnio naładowane jądro jest do niego przyciągane (zgodnie z biegiem fizyki) i cząsteczka jest osadzona. W tej kolejności połączenie chemiczne jest wynikiem sił dielektrycznych. Widać to wyraźnie na schemacie:

Slid zaznachit, scho u podstaw iluminacji wiązania kowalencyjnego, podobnie jak w przypadku wadliwego wiązania jonowego, leżą w grze przeciwnych ładunków.
Na koniec spójrzmy na algorytm odbicia lustrzanego, który jest niezbędny do zapisania schematu oświetlania wiązania kowalencyjnego np. dla cząsteczki azotu N 2 .
1. Azot jest elementem podgrupy głowy grupy V (grupa VA). Atomy Yogo mogą mieć pięć elektronów na płaszczyźnie zewnętrznej. Aby określić liczbę niesparowanych elektronów, przyspiesz wzór:
8 - N = liczba niesparowanych elektronów,
de N to numer grupy pierwiastków chemicznych.
Wtedy atom azotu ma (8-5 = 3) trzy niesparowane elektrony.
2. Zapiszmy znaki pierwiastków chemicznych ze znaków znanych elektronów w taki sposób, aby niesparowane elektrony zostały sprowadzone do znaku sądowego:
![]()
3. Zapiszmy elektroniczny wzór strukturalny cząsteczki, który został ustalony:
Jeśli atom jest związany pojedynczą parą elektronów, to takie wiązanie kowalencyjne nazywa się pojedynczym, jeśli dwa są połączone, jeśli potrójnym, jeśli potrójnym.
Im więcej par elektronowych znajduje się w atomach w cząsteczce, tym bardziej smród łączy się jeden z jednym i tym mniej stoisz między jądrami atomów, jak to nazywają podwójnym ogniwem. W przypadku cząsteczek fluoru połączenie jest pojedyncze, a połączenie między jądrami atomów wynosi 0,14 nanometra (1 nm = 10 -9 m lub 0,000000001 m). W cząsteczkach azotu połączenie zostaje utracone, a długość jogi wynosi 0,11 nm. Aby podzielić cząsteczkę azotu na kilkanaście atomów, należy ją zmielić w przybliżeniu sim razy więcej energii niższy dla rozwoju pojedynczych wiązań w cząsteczce fluoru.
Słowa i frazy kluczowe
- Wiązanie chemiczne lub kowalencyjne.
- Pojedyncze, subvintage i utrata kowalencyjnych wiązań chemicznych.
- Zadzwoń Dovzhina.
- Elektroniczne wzory strukturalne.
Robot z komputerem
- Wróć do programu elektronicznego. Przeczytaj materiał do lekcji i przeczytaj instrukcje dotyczące zadania.
- Znajdź adresy e-mail w Internecie, które mogą być dodatkowymi dzherelami, kakі rozkryvayut zmіst słowami kluczowymi i frazami akapitu. Poproś nauczyciela o pomoc w przygotowaniu nowej lekcji - aby dowiedzieć się więcej o słowach kluczowych i frazach z następnego akapitu.
Zapytanie i zadanie
- Wszystkie elementy głównej podgrupy grupy VII (grupa VIIA) układu okresowego D. I. Mendeliew (podgrupy fluoru) wygłasza proste przemówienia, które składają się z cząsteczek dwuatomowych. Zapisz schemat elektroniczny oświetlania wzoru strukturalnego takich cząsteczek, wikorystycznego znaku chemicznego dla wszystkich podgrup G (halogen).
- Zapisz schematy tworzenia wiązań chemicznych przemówień, których magazyn pokazują wzory KC1 i C1 2.
- Ile niesparowanych elektronów mogą atomy sirki? Jakie ogniwo będzie w cząsteczkach S2? Napisz schemat tworzenia wiązania chemicznego w cząsteczkach S2.
- Schowaj kolejność zwiększania ilości składu chemicznego mowy wzorami S 2 , Cl 2 , N 2 i zakreśl poprawność swojej decyzji. Jak zmienić długość ogniwa w cząsteczkach złożonego rzędu?
- Podziel mowę na dwie grupy według rodzaju wiązania chemicznego: N2, Li2O, KS1, O2, CaF2, H2.
Temat: wiązanie kowalencyjne niepolarne
Menedżer:
Sformułuj stwierdzenie dotyczące wiązania kowalencyjnego, wiązania kowalencyjnego niepolarnego;
Pokaż mechanizm powstawania wiązania kowalencyjnego niepolarnego;
Prodovzhit razvitok umіn analіzuvati, robiti vysnovki;
Kultura Vihovuvat spіlkuvannya.
Motywacja i cel:
Dlaczego azot i woda występują w pozornie dwuatomowych cząsteczkach? W procesie rozmovi zdіysnyuєmo svіlne tsіlepokladannya że vyznaєmo temat lekcji.
Wprowadzenie nowego materiału:
Przyjrzyjmy się, jak powstaje wiązanie chemiczne w cząsteczceCl 2.
Atom chloru znajduje się wVIIAGrupa Układu Okresowego ma więc do ukończenia nie więcej niż jeden elektron na tym samym poziomie energetycznym. Sześć elektronicznych równych stawia zakłady i jeden niedopasowany. Dwa atomy chloru, jak jeden niesparowany elektron każdy, zbliżają się do siebie, elektrony „łączą się” i stają się jaśniejsze niż oba atomy, uzupełnimy rząd naszego stada - osiem elektronów. Kilka elektronów można rozpoznać po prostu po ryżu.
Dlatego wiązanie kowalencyjne, ale atomowe, jest tym samym wiązaniem chemicznym, które jest odpowiedzialne za wynik adopcji żarzących się par elektronów.
Ten związek chemiczny jest ustanowiony między atomami tego samego niemetalu, za pomocą zaciekłego zakładu elektronicznego, tak jakby się ustatkowały, leżą na obu atomach w równym świecie i na tym samym jednym z nich nie będzie zbędny, brak ładunku ujemnego, dlatego to wiązanie kowalencyjne jest niepolarne.
Podobnie rozpuszcza się cząsteczka H 2. Jednak atom często znajduje się wIAgrupy, do tego w skórze atom wody może mieć tylko jeden elektron i do końca stary poziom energii Nie mogę się nacieszyć tylko jednym elektronem (zgaduję, że dla atomów rozbitych na wodę i hel ważne jest dopełnienie, tak jak na nowym są 2 elektrony). Atom skóry może pobierać jeden elektron na raz, a niesparowane elektrony łączą się, zaspokajając naładowaną parę elektronów, dzięki czemu można rozpoznać, jak małe są zdjęcia.
Ponadto, gdy dwa atomy znajdują się blisko siebie, skóra niektórych z nich może być jednym s-elektronicznym mrokiem o kulistym kształcie, obserwuje się nakładanie się tych elektronicznych mroków. Kiedy obszar jest ustalony, ładunek ujemny jest duży, dodatnio naładowane jądra są do niego przyciągane i powstaje cząsteczka.

Przyjrzyjmy się mechanizmowi powstawania dużej zwiniętej cząsteczki 2 .
Kisen jest wPRZEZgrupa, otzhe, może 6 elektronów na tym samym poziomie. Aby obliczyć liczbę niesparowanych elektronów, możesz użyć wzoru 8 -n, den- Numer grupy. Dlatego w atomie skóry będą po 2 niesparowane elektrony, które wezmą udział w ustanowionym wiązaniu chemicznym. Dwa niesparowane elektrony łączą się z dwoma innymi niesparowanymi elektronami drugiego atomu i powstają dwa duże zakłady elektronów, które możesz sobie wyobrazić, patrząc na dwie figi.
Odłamki ogniw w cząsteczce kwasu składają się z dwóch par elektronów, które nazywają się metrem, będą większe, niższe, pojedyncze, jak cząsteczka wody. Ale wymaga zrozumienia, jakie jest najmniejsze ogniwo między atomami w cząsteczce, im mniejsza jest odległość między jądrami atomów. Tsya vіdstan nazywa się starym zv'yazku. Trzeci link jest wciąż skrótem od fiszbin, ale bogato mіtsnіshiy. Na przykład w cząsteczce azotu dochodzi do utraty połączenia, aby rozbić cząsteczkę na dwa atomy, trzeba użyć dużo więcej energii, niżej do zerwania pojedynczego połączenia w cząsteczce chloru.
Uzagalnennya, że systematyzacja wiedzy:
Które wiązanie chemiczne nazywa się kowalencyjnym?
Między atomami których pierwiastków powstają kowalencyjne wiązania niepolarne?
Jaka jest istota ustanowienia wiązania kowalencyjnego?
Dlaczego pojedynczy zv'yazok kończy się w postaci wiszącej i wiszącej?
Co pokaże ci link i po co kłamać?
Skonsolidowana wiedza z zakresu kontroli:
Ułóż schematy rozpuszczania cząsteczek mowy: a) brom; b) fluor; c) azot.
Wyłącz linię skóry:
a) CO 2 , NH 3 , P 4 , P 2 O 5 ;
b)Cl 2 , S, N 2 , CO 2 .
Sugestia:
a)P 4 ; b)Cl 2 , S, n 2 . Cerebro z kowalencyjnym niepolarnym wiązaniem.
Wybierz przemówienia z kowalencyjnym wiązaniem niepolarnym:
P 4 , H 2 S, NH 3 , P 2 O 3 , S, N 2 , O 2 , H 2 O, HCl, H 2 .
Sugestia: mowa z kowalencyjnym niepolarnym lepkim roztworem tych samych atomów niemetali, będzie toP 4 , S, n 2 , O 2 , h 2 .
Odbicie i pidbitya pidsumkiv:
Jak dbasz o opanowanie materiału do lekcji? dobry; b) dobry; c) całkiem; d) nie nabyte.
Czy możesz mi od razu opowiedzieć o jedzeniu, tak jak kładziemy je na kolbie lekcji?
Zadania domowe:
ir.: §11, przykł. trzynaście;
IIrіven: tezh + ex. 4, 5.