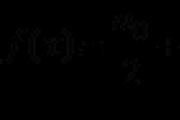Su demostración de química. Trivalidad ЄDI z chemії
El 14 de noviembre de 2016 se publicó la versión aprobada en el sitio web del FIPD opciones de demostración, codificador y especificidad de los materiales de control de la investigación estatal única y la investigación estatal principal en 2017, incluida la química.
Versión de demostración de ЄDI z khimiї 2017
| Opción zavdan + vіdpovіdі | Obtenga una versión de demostración |
| Especificación | variante de demostración himiya ege |
| codificador | codificador |
Versión de demostración de química EDI z 2016-2015
| Química | Obtenga una versión demo + reseñas |
| 2016 | 2016 |
| 2015 | 2015 |
En KIM z khimiї u 2017 roci suttєvі chіnі, por lo que se ha presentado la versión de demostración de los destinos pasados para su aclaración.
Química: la esencia del cambio: se optimizó la estructura del trabajo de examen:
1. La estructura de la parte 1 de KIM se cambió fundamentalmente: la tarea se desactivó con la elección de un candidato; la tarea de agrupar bloques temáticos de okremi, para la piel de tales є la tarea del básico y el nivel avanzado de plegado.
2. Cambió el número total de trabajos de 40 (2016) a 34.
3. Se cambió la escala de valoración (de 1 a 2 puntos) a la cabeza del nivel básico de plegado, con el fin de reconsiderar los conocimientos adquiridos sobre el vínculo genético de los discursos inorgánicos y orgánicos (9º y 17º).
4. El primer puntaje máximo para robótica victoriosa es de 60 puntos (reemplazado 64 puntos para 2016).
Trivalidad ЄDI z chemії
La duración total del período de examen es de 3,5 años (210 minutos).
Hora aproximada, cuando comienza el vikonanny okremikh zavdan, para convertirse en:
1) para el ajuste de la piel del nivel básico de plegado de las púas de la parte 1-2-3;
2) para el cuidado de la piel promovido igual partes plegables 1-5-7 púas;
3) para el cuidado de la piel de un alto nivel de plegado, una parte de 2-10-15 púas.
Especificación
materiales de control
para la rotación 2017 de Estados Unidos Spitu
QUÍMICA
1. Designación de KIM EDI
La única experiencia estatal (más adelante - ЄДІ) es una forma de evaluación objetiva de la calidad de la formación de los estudiantes, ya que han dominado los programas educativos de la educación media. educación mundial, A partir de la selección de la forma estandarizada (materiales de control).
ЄДІ se llevará a cabo de conformidad con la Ley Federal del 29 de diciembre de 2012 No. 273-ФЗ "Sobre la educación en la Federación Rusa".
Los materiales de control permiten establecer el nivel de dominio de los egresados del componente Federal del estándar estatal de la educación media (nueva) global en química, nivel básico y de perfil.
Los resultados de la investigación soberana única en química son reconocidos por las organizaciones de iluminación del medio. educación profesional y esclarecer a las organizaciones de educación profesional superior como resultado de los exámenes de ingreso en química.
2. Documentos a emitir por KIM EDI
3. Llegar a la selección de un reemplazo, análisis de estructura de KIM EDI
La base de insumos antes de la distribución de KIM EDI 2017 z khіmії plegó las instalaciones metódicas de zagalnі, yakі fueron designados en el curso del moldeado modelos de examen rocas anteriores. La esencia de estas instalaciones es el eje y.
- КІМ está orientado a la reverificación del sistema de conocimiento adquirido, que se considera como un núcleo invariable de los mismos programas en desarrollo en química para organizaciones globales de iluminación. En la norma, el sistema de conocimientos se presenta como una ayuda para la preparación de los egresados. Zimi vymogami spіvvіdnositsya rіvennja prіvlennya in KІM elementos vmіstu, scho verіryayutsya.
- Para garantizar la posibilidad de diferenciar la evaluación de los logros iniciales de los graduados de KIM ЄDI zdіysnyuyut reverificación del dominio de los principales programas educativos en química en tres niveles de complejidad: básico, avanzado y alto. Material inicial, cuyos cimientos serán la tarea, son seleccionados por el signo de su significado para la formación global de los egresados de la escuela secundaria.
- Vikonannya zavdan ekzamenatsiynoi roboti transfiriendo zdiisnennya cantando sukupnosti diy. Entre ellos, los más ostentosos son, por ejemplo, así: mostrar al clasificador signos de habla y reacciones; seleccionar estado de oxidación elementos químicos detrás de las fórmulas de sus punto y coma; explique la esencia de ese proceso chi inshoy, almacén vzaєmozv'yazku, sea ese poder de los discursos. El vmіnnya izmenovanogo zdіysnyuvati raznomanіtnі dії en vykonannye roboti se considera un indicador de la asimilación del material retorcido con la profundidad de comprensión necesaria.
- La equivalencia de todas las variantes del trabajo de examen se garantiza mediante la introducción del mismo nivel de calificación de la tarea, que se reconsidera mediante la adquisición de los elementos principales de las divisiones clave del curso de química.
4. Estructura de KIM EDI
Variante de la piel del trabajo de examen de indicaciones para un solo plan: el trabajo consta de dos partes, que incluyen 40 tareas. Parte 1 del día 35 del breve descanso, en medio de ellas el día 26 del nivel básico de plegado (números de serie del pedido: 1, 2, 3, 4, ... 26) y el día 9 de el nivel avanzado de plegado (el orden del día del orden: 27, 28, 29 , …35).
Parte 2 para vengar el 5º día de un alto nivel de plegado, con fuego abierto (números secuenciales de estos órdenes: 36, 37, 38, 39, 40).
Las pruebas típicas de la tarea de química se llevaron a cabo 10 variantes de conjuntos de pruebas, dobladas para mejorar las características necesarias y en aras del sueño soberano único en 2017. El propósito de la ayuda es brindar a los lectores información sobre la estructura del estudio de química KIM 2017, el grado de complejidad de la tarea.
Al muestreador se le dio una opinión sobre todas las opciones de prueba y se tomó una decisión sobre todas las tareas de una de las opciones. Además, se dibujaron los signos de los espacios en blanco, como si fueran victoriosos en ЄDI, para registrar las opiniones de esa decisión.
El autor es un científico destacado, un empleado y un metodólogo, que participa ininterrumpidamente en el desarrollo de materiales de control vimiruvalnyh del EDI.
Ayudante de citas para profesores para la preparación de estudiantes para estudiar química, así como para estudiantes de secundaria y estudiantes de posgrado, para la autoformación y el autocontrol.
solicitar.
El cloruro de amonio tiene enlaces químicos:
1) iones
2) covalente polar
3) covalente no polar
4) agua
5) metales
A partir de la traducción propionada de los discursos, envuelve dos discursos, con la piel reaccionando con algunas reacciones.
1) cloruro de zinc (solución)
2) sulfato de sodio (solución)
3) ácido nítrico diluido
4) ácido sulfúrico concentrado
5) óxido de aluminio
ZMIST
peredmova
Instrucciones para vikonannya roboti
OPCIÓN 1
parte 1
parte 2
OPCION 2
parte 1
parte 2
OPCIÓN 3
parte 1
parte 2
OPCIÓN 4
parte 1
parte 2
OPCIÓN 5
parte 1
parte 2
OPCIÓN 6
parte 1
parte 2
OPCIÓN 7
parte 1
parte 2
OPCIÓN 8
parte 1
parte 2
OPCIÓN 9
parte 1
parte 2
OPCIÓN 10
parte 1
parte 2
VEA ESA DIFERENCIA
Vіdpovіdі hasta el jefe de la parte 1
La decisión y la fecha límite para la parte 2
Razv'yazannya tarea variante 10
parte 1
Parte 2.
Zavantazhity gratuito libro electronico en formato manual, maravíllese y lea:
Descargue el libro ЄДІ 2017, Química, Tareas de prueba típicas, Medvedev Yu.M. - fileskachat.com, descargas gratuitas.
- ЄDI 2020, Química, Opciones típicas para preguntas de examen en minoristas ЄDI, Medvedev Yu.M., 2020
- ЄDI 2019, Química, Experto en ЄDI, Medvedev Yu.M., Antoshin A.E., Ryabov M.A.
- ODE 2019, Química. 32 opciones, Pruebas de tipo para la distribución de ODE, Molchanova G.M., Medvedev Yu.M., Koroshenko O.S., 2019
- Química, la única prueba soberana, Preparándose para la certificación de la bolsa secundaria, Kaverina A.A., Medvedev Yu.M., Molchanova G.M., Sviridenkova N.V., Snastina M.G., Stakhanova S.V., 2019
Para vikonannya zavdan 1-3 vikoristovyte la siguiente fila de elementos químicos. Vіdpovіddu en zavdannya 1–3 є secuencia de dígitos, bajo los cuales se indican los elementos químicos en esta fila.
1) Na 2) K 3) Si 4) Mg 5) C
Gerente No. 1
Significativamente, los átomos de algunos de los significados de una serie de elementos pueden estar en el exterior energía igual electrónica chotiri.
Sugerencia: 3; 5
El número de componentes electrónicos en el mismo nivel de energía (bola electrónica) de los elementos de los subgrupos principales es igual al número del grupo.
En tal rango, el silicio y el carbón son adecuados para presentar opciones para vіdpovіdey, porque los apestosos están recomprando del subgrupo de cabeza del cuarto grupo de la tabla D.I. Mendeliev (grupo ІVA), tobto. virnі vіdpovіdі 3 y 5.
Gerente No. 2
De las citas para una serie de elementos químicos, seleccione tres elementos, como en el Sistema periódico de elementos químicos D.I. Mendeliev está recomprando en un período. Guarda los elementos seleccionados en el orden del crecimiento de sus poderes metálicos.
Escriba en el campo los números de los elementos seleccionados en la secuencia requerida.
Sugerencia: 3; 4; una
Hay tres representaciones de elementos en un período: sodio Na, silicio Si y magnesio Mg.
En Rusia en las fronteras del período de la Tabla Periódica D.I. Mendeliev (filas horizontales) diestros a la izquierda, es más fácil dar electrónica, extendiéndolas a la bola exterior, tobto. se fortalece el poder metálico de los elementos. De esta forma, se refuerza la dominancia metálica de sodio, silicio y magnesio en la serie Si Gerente No. 3 3-valores alternos en un número de elementos, seleccione dos elementos, ya que revelan el estado de oxidación más bajo, igual a -4. Anote los números de los elementos seleccionados en el campo. Sugerencia: 3; 5 Como regla general, un octeto, átomos de elementos químicos, debe tener sus propios electrones iguales de nivel electrónico 8, como en los gases nobles. A lo que se puede llegar ya sea suministrando los electrones restantes, los mismos que el delantero, que puede vengar 8 electrones, o agregando electrones adicionales hasta ocho. El sodio y el potasio se elevan para formar charcos de metales y se encuentran en el subgrupo principal del primer grupo (IA). Tse significa que la misma bola de electrones tiene un electrón cada una. En el enlace con el cym enérgicamente vygіdnіshoy є vtrata solo electrón, más bajo que la adición de siete más. Con el magnesio, la situación es similar, solo los vinos están en el subgrupo de cabeza de otro grupo, por lo que hay dos electrones en el nivel electrónico principal. Cabe señalar que el sodio, el potasio y el magnesio se anteponen a los metales, y los metales en principio no pueden tener una etapa de oxidación negativa. El grado mínimo de oxidación de cualquier metal es igual a cero y se observa en discursos simples. Los elementos químicos del carbón C y el silicio Si є no metales y están en el subgrupo principal del cuarto grupo (IVA). Tse significa que hay 4 electrones en su bola de electrones más externa. Por lo tanto, para estos elementos, es posible suministrar esta electrónica, por lo que es posible agregar más al número grande, que es más caro 8mi. Más de 4 electrones en átomos de silicio y carbono son imposibles, por lo que el nivel de oxidación mínimo es -4. Gerente No. 4 Elija dos semestres de la mezcla propuesta, en los que exista un enlace químico iónico. Sugerencia: 1; 3 La presencia de un enlace de tipo iónico en el compuesto se puede atribuir de la manera más importante al hecho de que los átomos de un metal típico y el átomo de un no metal entran al mismo tiempo en una de las unidades estructurales. Para ello, estableceremos que el enlace iónico está en el mismo bajo el número 1 - Ca (ClO 2) 2, tk. en esta fórmula, es posible suministrar átomos del calcio metálico típico y átomos de no metales: ácido y cloro. Sin embargo, ya no hay posibilidad de vengarse de los átomos de metal y no metal en la lista designada. Hay más signos sobre la presencia de un enlace iónico en la vida cotidiana, es posible decir que en el almacén de esta unidad estructural hay un catión de amonio (NH 4 +) o sus análogos orgánicos: catión de alquilamonio RNH 3 + , dialquilamonio R 2 + NH2 3 N + i tetraalquilamonio R 4 N + , de R - radical carbohidrato desequilibrado. Por ejemplo, se puede encontrar un enlace de tipo iónico en la unión (CH 3) 4 NCl entre el catión (CH 3) 4 + y el ion cloruro Cl - . El medio de las citas en la planta es cloruro de amonio, en el otro se realiza el enlace iónico entre el catión amonio NH 4 + y el ion cloruro Cl − . Gerente No. 5 Establezca la posición entre la fórmula del discurso y la clase / grupo, para acostarse al tipo (-oї) del discurso: a la posición de la piel, indicada por una letra, seleccione la posición desde otra posición, indicada por un número. Anote los números del día elegido en el campo. Testimonio: A-4; B-1; 3 Explicación: Las sales ácidas se llaman sales, que aparecieron como resultado de una sustitución incompleta de los átomos de rukhomi en el agua por un catión metálico, un catión de amonio o un alquilamonio. En los ácidos inorgánicos, que pasan por el marco de un programa escolar, todos los átomos y el agua se pudren, para que puedan ser reemplazados por metal. Los extremos de las sales de ácidos inorgánicos del medio presentado en la lista son bicarbonato de amonio NH 4 HCO 3, el producto de reemplazar uno de los dos átomos de agua en ácido carbónico con un catión de amonio. De hecho, la fuerza ácida es media entre la acidez normal (promedio). En el caso de NH 4 HCO 3 - medio entre el umbral normal (NH 4) 2 CO 3 y ácido carbónico H 2 CO 3. En los discursos orgánicos, solo el átomo y el agua se reemplazan en átomos de metal, que ingresan al almacén de grupos carboxilo (-OOH) o grupos hidroxilo de fenoles (Ar-OH). Tobto, por ejemplo, acetato de sodio CH 3 COONa, independientemente de los que en esta molécula no son todos los átomos y sustitución de agua en cationes metálicos, medio, y ácido no ácido (!). El agua atómica en los discursos orgánicos, unida sin medio al átomo de carbono, es prácticamente imposible sustituirla por un átomo de metal, por agua atómica en agua con triple enlace C-W. Óxidos que no forman sal: óxidos de no metales, yak utvoryut con óxidos básicos y bases de sal, por lo que no reaccionan con él (la mayoría de las veces), o la reacción tiene otro producto (no fuerte ). A menudo parece que los óxidos no salinos son óxidos no metálicos que no reaccionan con bases y óxidos básicos. Prote, la manifestación de óxidos que no forman sal es un pidhid spratsovuє zavzhd. Entonces, por ejemplo, el CO, al ser un óxido no salino, reacciona con el óxido principal de la solución salina (II), pero con soluciones no de sal, sino de metal libre: CO + FeO = CO2 + Fe A los óxidos no salinos en el curso de química del bachillerato se les incluye los óxidos no metálicos en la etapa de oxidación +1 y +2. El їх de Usy es sustrichaetsya en ЄDI 4 - tse CO, NO, N 2 O y SiO (el SiO restante no es especialmente sustrichavsya en zavdannya). Gerente No. 6 De la traducción propionada de los discursos, envuelve dos discursos, de la piel, que reaccionan bien sin calentarse. Sugerencia: 2; 4 El cloruro de zinc se agrega a las sales y el cloruro de zinc a los metales. El metal reacciona de tonto solo en ese caso, ya que es más activo al mismo tiempo, que ingresa al almacén de sal. La actividad significativa de los metales se debe a la baja actividad de los metales (en otras palabras, una serie de tensiones de los metales). Zalizo en la serie de actividad de los metales es más adecuado para el zinc, pero es menos activo y no es más probable que elimine el zinc de la sal. Es por eso que la reacción de la sala del discurso No. 1 no va. El sulfato midi (II) CuSO 4 reaccionará con la solución salina, ya que la saliva figura como midi en la serie de actividad, por lo que es un metal más activo. El ácido nítrico concentrado, así como el ácido sulfúrico concentrado, no funcionan sin calentamiento, reaccionando con sal, aluminio y cromo en la aparición de tal fenómeno, como pasivación: en la superficie de estos metales, bajo la influencia de ácidos, se vuelve indestructible sin calentar la defensa de silicona. Prote cuando se calienta, la cáscara se expande y la reacción se vuelve posible. Tobto. se asignan fragmentos, no puedo calentar, la reacción de la sala con conc. HNO 3 no tiene fugas. El ácido clorhídrico se puede agregar a los ácidos no oxidantes independientemente de la concentración. Reaccionaron con ácidos no oxidantes con agua, que debería estar al lado de la actividad del agua. A tales metales se encuentran cerca. Visnovok: reacción de inundación con fugas de ácido clorhídrico. En tiempos de metal y óxido de metal, la reacción, como y en depresión de tonta, es posible, ya que el metal más activo es para los que ingresan al depósito de óxido. Fe, cercano a la actividad de los metales, menos activo, menor Al. Tse significa que Fe s Al 2 O 3 no reacciona. Gerente No. 7 Se toman dos óxidos de la perelika proponada, ya que reaccionan con diferentes ácidos clorhídricos, ale no reacciones
de una variedad de hidróxido de sodio. Anote los números de los discursos seleccionados en el campo. Sugerencia: 3; 4 El CO es un óxido no salino, no reacciona con las praderas acuáticas. (Siguiendo la memoria, sho, no menos, en mentes zhorst - alta presión y temperatura - el vino todavía reacciona con una pradera dura, formando formas - sales de ácido fórmico). SO 3 - óxido de azufre (VI) - óxido ácido, que es similar al ácido sulfúrico. Los óxidos de ácido no reaccionan con los ácidos y otros óxidos de ácido. Entonces SO 3 no reacciona con ácido clorhídrico y reacciona con la base: hidróxido de sodio. no te vayas CuO - óxido midi (II) - se puede convertir en óxidos con la potencia principal. Reacciona con HCl y no reacciona con hidróxido de sodio. Venir MgO - óxido de magnesio - se puede convertir en óxidos básicos típicos. Reacciona con HCl y no reacciona con hidróxido de sodio. Venir El ZnO es un óxido con poderes anfóteros claramente pronunciados: reacciona fácilmente tanto con bases fuertes como con ácidos (así como con óxidos ácidos y básicos). no te vayas Gerente No. 8 Sugerencia: 4; 2 Cuando reacciona con dos sales de ácidos inorgánicos, es menos probable que el gas se disuelva cuando los nitritos calientes y las sales de amonio se mezclan después de que se disuelva el nitrito de amonio térmicamente inestable. Por ejemplo, NH 4 Cl + KNO 2 \u003d to \u003d\u003e N 2 + 2H 2 O + KCl Sin embargo, la lista no incluye nitritos y sales de amonio. Además, una de las tres sales (Cu(NO 3) 2 , K 2 SO 3 y Na 2 SiO 3) reacciona con ácido (HCl) o con pradera (NaOH). Entre las sales de ácidos inorgánicos, solo las sales de amonio ven gas cuando interactúan con los prados: NH 4 + + OH \u003d NH 3 + H 2 O Sal de amonio, como ya dijimos, no hay lista. Ya no existe una opción para la interacción de la sal con el ácido. A las sales del medio del significado de los discursos, se encuentran Cu (NO 3) 2, K 2 SO 3 y Na 2 SiO 3. La reacción del nitrato de midi del ácido clorhídrico no continúa, porque no te conformes con gas, ni asedio, ni discurso de baja disociación (plomo o ácido débil). El silicato de sodio reacciona con ácido clorhídrico; Na 2 SiO 3 + 2HCl \u003d 2NaCl + H 2 SiO 3 ↓ Se abandona la opción restante: la interacción del sulfito de potasio y el ácido clorhídrico. En efecto, como resultado de la reacción de intercambio iónico entre el sulfito y prácticamente cualquier ácido, se disuelve un ácido no sulfuroso, de hecho, se descompone en un óxido de azufre (IV) similar a un gas sin barra y agua. Gerente No. 9 Escriba en la tabla los números de los discursos seleccionados debajo de las letras correspondientes. Sugerencia: 2; 5 El CO 2 se lleva a óxidos ácidos y, para convertirlo en vigor, es necesario elevarlo con un óxido básico o con una base. Tobto. Para eliminar el carbonato de potasio del CO 2, es necesario agregarle óxido de potasio o hidróxido de potasio. En este orden, el habla X es óxido de potasio: K 2 O + CO 2 \u003d K 2 CO 3 Bicarbonato de potasio KHCO 3, yak y carbonato de potasio, і sіllyu vugіlnoї acid, tієyu menos diferencia, scho bicarbonate є producto de sustitución incompleta de átomos en agua de ácido vugіlnіy. Para quitar la sal normal (media), fuerza ácida, es necesario o leudarla con ácido pesado, que es la fuerza que se establece, o leudarla con óxido ácido, que exacerba este ácido, en presencia de agua. Así, el reactivo Y es dióxido de carbono. Cuando se pasa yoga por una solución acuosa, queda carbonato de potasio para pasar a bicarbonato de potasio: K 2 CO 3 + H 2 O + CO 2 \u003d 2KHCO 3 Gerente No. 10 Establezca la diferencia entre reacciones igual a la potencia del elemento al nitrógeno, como si estuviera en su reacción: a la posición de la piel, indicada por una letra, para elegir la posición correcta, indicada por un número. Escriba en la tabla los números de los discursos seleccionados debajo de las letras correspondientes. Testimonio: A-4; B-2; EN 2; G-1 A) NH 4 HCO 3 - fuerza, al almacén, que incluye el catión de amonio NH 4 +. En el catión amonio, el nitrógeno es el principal paso de oxidación, que es -3. Como resultado de la reacción, el vino se convierte en amoníaco NH 3 . El agua es prácticamente zavzhdi (krim yogo spoluk z metales) en varias etapas de oxidación, lo cual es bueno +1. Al hecho de que la molécula de amoníaco era eléctricamente neutra, el nitrógeno tiene la culpa de la madre de la etapa de oxidación, que es saludable -3. Otzhe, cambiar la etapa de oxidación a nitrógeno no es posible, tobto. los vinos no muestran poderes dominantes de óxido. B) Como se muestra arriba, el nitrógeno en el amoníaco NH 3 se puede oxidar a -3. Como resultado de la reacción con CuO, el amoníaco se convierte en N 2 del habla simple. En presencia de un discurso simple, las etapas de oxidación del elemento, como si estuviera establecido, son iguales a cero. De esta manera, el átomo de nitrógeno pierde su carga negativa y los fragmentos de carga negativa dan electrones, lo que significa que el átomo de nitrógeno la pierde como resultado de la reacción. Un elemento que pierde parte de sus electrones como resultado de una reacción se llama fuente. C) Como resultado de la reacción del NH 3 con la etapa de oxidación a nitrógeno, que conduce a -3, se convierte en óxido de nitrógeno NO. Kisen prácticamente planta el mayor grado de oxidación, que es bueno -2. Para que la molécula de óxido de nitrógeno sea eléctricamente neutra, el átomo de nitrógeno es el responsable de la madre del estado de oxidación +2. Tse significa que el átomo de nitrógeno después de la reacción cambia su paso de oxidación de -3 a +2. No vale la pena hablar de la pérdida de 5 electrones por parte del átomo de nitrógeno. Tobto nitrogen, like y trapleyaetsya B, є vіdnovnikom. D) N 2 - discurso simple. En todos los discursos simples, el elemento que los compone puede tener un estado de oxidación saludable 0. Como resultado de la reacción, el nitrógeno se convierte en nitruro de litio Li3N. Una sola etapa de oxidación del charco de metal, una crema de cero (una etapa de oxidación de 0 se puede encontrar en cualquier elemento), buena +1. De esta forma, para que la unidad estructural del Li3N sea eléctricamente neutra, el nitrógeno es el responsable de la madre de los pasos de oxidación, que es -3. Salga, como resultado de la reacción, el nitrógeno ha ganado una carga negativa, lo que significa la llegada de electrones. El nitrógeno en esta reacción es oxidante. Gerente No. 11 Para establecer la posición entre fórmula de habla y reactivos, con la piel de cualquiera de estas habla se puede combinar: a la posición de la piel, indicada por una letra, a tomar la posición correcta, indicada por un número. D) ZnBr 2 (solución) 1) AgNO3, Na3PO4, Cl2 2) BaO, H2O, KOH 3) H2, Cl2, O2 4) HBr, LiOH, CH3COOH 5) H3PO4, BaCl2, CuO Escriba en la tabla los números de los discursos seleccionados debajo de las letras correspondientes. Testimonio: A-3; B-2; A LAS 4; G-1 A) Cuando se hace pasar agua gaseosa a través de la fusión del sirka, se establece el agua circulante de H 2 S: H 2 + S \u003d to \u003d\u003e H 2 S Cuando se pasa cloro sobre el azufre ajustado a temperatura ambiente, se disuelve el dicloruro de azufre: S + Cl 2 \u003d SCl 2 Para edificios EDI sepa con certeza cómo reacciona la sirka con el cloro y no es necesario registrarlo. Golovnya: en un nivel de memoria basado en principios, scho sirka reacciona con cloro. El cloro es un fuerte agente oxidante, sirka a menudo muestra una función subyacente, como un oxidante, por lo que es energizante. Tobto, como un agente oxidante fuerte, como el cloro molecular Cl 2, se oxidará. Sirka quema medias luces azules cerca de gas agrio con un fuerte olor: dióxido de azufre SO 2: B) SO 3 - óxido de azufre (VI) puede mostrar claramente poder ácido. Para tales óxidos, las reacciones más características son las interacciones con el agua, así como con los óxidos e hidróxidos básicos y anfóteros. La lista bajo el número 2 incluye agua, óxido básico BaO e hidróxido KOH. Cuando el óxido ácido interactúa con el óxido básico, la fuerza del ácido ácido y el metal se disuelven, lo que ingresa al almacén del óxido básico. Para un óxido ácido, se añade ese ácido, en cuyo elemento formador de ácido puede tener el mismo grado de oxidación que en el óxido. El óxido SO 3 se trata con ácido sulfúrico H 2 SO 4 (y ahí, y ahí está más avanzada la etapa de oxidación +6). De esta forma, con la interacción del SO 3 con los óxidos metálicos, se producirán sales de ácido sulfúrico -sulfato, que sustituirán al ion sulfato SO 4 2-: SO3 + BaO = BaSO4 Al interactuar con el agua, el óxido ácido se convierte en un ácido ácido: SO 3 + H 2 O \u003d H 2 SO 4 Y con la interacción de óxidos ácidos con hidróxidos metálicos, la fuerza del agua ácida hidratada se disuelve: SO 3 + 2KOH \u003d K 2 SO 4 + H 2 O C) El hidróxido de zinc Zn(OH) 2 puede tener una especie de poder anfótero, de manera que reacciona tanto con óxidos ácidos y ácidos, como con óxidos básicos de sodio. La lista tiene 4 bachims como ácidos - bromo-agua HBr y otsov, y pradera - LiOH. Adivinemos qué prados se llaman agua-hidróxido-metales: Zn(OH)2 + 2HBr = ZnBr2 + 2H2O Zn (OH) 2 + 2CH 3 COOH \u003d Zn (CH 3 COO) 2 + 2H 2 O Zn(OH) 2 + 2LiOH \u003d Li 2 D) Bromuro de zinc ZnBr 2 є sіllu, rozchinny v vodі. Para las sales al por menor, las reacciones más extendidas de intercambio iónico. La fuerza puede reaccionar con otra fuerza para la mente, que los insultos de las sales viudas se propaguen y se establezca el asedio. Además, ZnBr 2 para retardar el ion bromuro Br-. Para los haluros metálicos, es característico que los hedores del edificio reaccionen con los halógenos Hal 2, que se encuentran más en las tablas de Mendeliev. ¿Por tal rango? las descripciones de los tipos de reacciones proceden de la lista 1: ZnBr 2 + 2AgNO 3 \u003d 2AgBr + Zn (NO 3) 2 3ZnBr2 + 2Na3PO4 = Zn3 (PO4)2 + 6NaBr ZnBr2 + Cl2 = ZnCl2 + Br2 Gerente No. 12 Establezca la posición entre el nombre del discurso y la clase / grupo, a qué (-ї) debe recostarse el discurso: a la posición de la piel, marcada con una letra, elija la posición correcta, marcada con un número. Escriba en la tabla los números de los discursos seleccionados debajo de las letras correspondientes. Testimonio: A-4; B-2; EN 1 Explicación: A) El metilbenceno es lo mismo que el tolueno, pero la fórmula estructural es: En la medida de lo posible, las moléculas de este discurso solo se pliegan en carbono y agua, por lo que se añade metilbenceno (tolueno) a los hidratos de carbono. B) La fórmula estructural de la anilina (aminobenceno) es la siguiente: Como es posible seguir la fórmula estructural, la molécula de anilina está compuesta por un radical carbohidrato aromático (C 6 H 5 -) y un grupo amino (-NH 2), de esta manera, la anilina se puede agregar a las aminas aromáticas, tobto . Sugerencia correcta 2. C) 3-metilbutanal. El final de "al" es para hablar de aquellos que hablan de aldehídos. Fórmula estructural del habla: Gerente No. 13 De la perelika propuesta, envuelva dos discursos, yakі є isómeros estructurales de buteno-1. Anote los números de los discursos seleccionados en el campo. Sugerencia: 2; 5 Explicación: Se denominan isómeros a los discursos que tienen la misma fórmula molecular y valor estructural, es decir. discursos, que se distinguen por el orden de los átomos, pero también por el depósito mismo de las moléculas. Gerente No. 14 Del perelіku propuesto, envuelva dos palabras, en caso de interacción con permanganato de potasio, será posible cambiar el zabarvlennya rozchiny. Anote los números de los discursos seleccionados en el campo. Sugerencia: 3; 5 Explicación: Los alcanos, así como los cicloalcanos con una expansión de anillo de 5 o más átomos de carbono, son inertes y no reaccionan con soluciones acuosas para formar agentes oxidantes fuertes, como, por ejemplo, permanganato de potasio KMnO 4 y dicromato de potasio K 2 Cr 2 O 7. De esta manera, las opciones 1 y 4 se caen: cuando se agrega ciclohexano o propano al nivel del agua de permanganato de potasio, no habrá cambios en la contaminación. Entre los carbohidratos en la serie homóloga del benceno, es pasivo a una variedad de variedades acuosas de oxidar solo el benceno, los homólogos pan se oxidan en barbecho en el medio o a ácidos carboxílicos, o a sales de hidroxilo. En este orden cae la variante 2 (benceno). Los correctos son 3 (tolueno) y 5 (propileno). Los discursos ofensivos irritan el color violeta del permanganato de potasio a través del exceso de reacciones: CH 3 -CH \u003d CH 2 + 2KMnO 4 + 2H 2 O → CH 3 -CH (OH) -CH 2 OH + 2MnO 2 + 2KOH Gerente No. 15 De la mezcla propuesta, envuelva dos palabras, con las reacciones de formaldehído. Anote los números de los discursos seleccionados en el campo. Sugerencia: 3; 4 Explicación: El formaldehído se introduce en la clase de aldehídos, compuestos orgánicos ácidos, que pueden formar el grupo aldehído al final de la molécula: Las reacciones típicas de los aldehídos son reacciones de oxidación y renovación que se desarrollan a lo largo del grupo funcional. En medio del cambio de reacciones para el formaldehído, una reacción característica es la renovación, como un agua vicaria (cat. - Pt, Pd, Ni), y la oxidación - en una reacción diferente de un espejo de plata. Con la adición de agua en un catalizador de níquel, el formaldehído se convierte en metanol: La reacción del espejo de plata es la reacción del descubrimiento de la diferencia entre el óxido de amoníaco de la plata. A diferencia del amoníaco acuoso, el óxido de sreble se convierte en una forma compleja: hidróxido de diaminaplata (I) OH. Después de la adición de formaldehído, se produce una reacción de oxidación-oxidación, en cuyo caso se observa: Gerente №16 De la mezcla propuesta, envuelva dos palabras, con las reacciones de metilamina. Anote los números de los discursos seleccionados en el campo. Sugerencia: 2; 5 Explicación: La metilamina es la manifestación más simple de compuestos orgánicos en la clase de aminas. Un rasgo característico de las aminas es la presencia de una apuesta de electrones no establecida en los átomos de nitrógeno, después de lo cual las aminas muestran el poder de las bases y las reacciones juegan el papel de los nucleófilos. De esta manera, en relación con cym iz, las variantes propuestas de metilamina como nucleófilo base reaccionan con clorometano y ácido clorhídrico: CH 3 NH 2 + CH 3 Cl → (CH 3) 2 NH 2 + Cl - CH 3 NH 2 + HCl → CH 3 NH 3 + Cl - Gerente №17 El esquema para la transformación de los discursos está por venir: Vznachte, yakі en zaznachenih speechovina є speechovina X e Y. Escriba en la tabla los números de los discursos seleccionados debajo de las letras correspondientes. Sugerencia: 4; 2 Explicación: Una de las reacciones es la retención de alcoholes y la reacción de hidrólisis de haloalcanos. De esta manera, es posible tomar etanol del cloroetano bebiéndolo en la pradera de agua restante, en esta gota de NaOH. CH 3 CH 2 Cl + NaOH (ac.) → CH 3 CH 2 OH + NaCl reacción ofensiva є reacción de oxidación alcohol etílico. La oxidación de los alcoholes se realiza sobre el catalizador medio o sobre las bases de cobre CuO: Gerente №18 Establezca la diferencia entre el nombre del habla y el producto, que es más importante establecer en la interacción del habla con el bromo: a la posición de la piel, indicada por una letra, para tomar la segunda posición, indicada por un número. Respuesta: 5; 2; 3; 6 Explicación: Para los alcanos, las reacciones más características son las reacciones de sustitución por radicales libres, en las que un átomo de agua se reemplaza por un átomo de halógeno. En este orden, el etano bromado se puede eliminar brometano y el isobutano bromado - 2-bromoisobutano: Las dispersiones de pequeños ciclos de moléculas de ciclopropano y ciclobutano son inestables, cuando los ciclos bromados de estas moléculas se curvan, de tal manera, la reacción procede: Sobre la base de los ciclos del ciclopropano y del ciclobutano, el ciclo del ciclohexano de los grandes romeros, tras el cual la sustitución del átomo de agua por el átomo de bromo: Gerente No. 19 Establecer una diferencia entre los discursos reactivos y un producto vengador del carbón, que se asienta con la interacción de estos discursos: a la posición de la piel, marcada con una letra, a la posición correcta, marcada con un número. Escriba en la tabla los números seleccionados debajo de las letras dobles. Respuesta: 5; 4; 6; 2 Gerente №20 De la lista propuesta de tipos de reacciones, elija dos tipos de reacciones, a las cuales se puede introducir una en combinación con charcos de metales del agua. Escriba los números de los tipos seleccionados de reacciones en el campo. Sugerencia: 3; 4 Los pools de metales (Li, Na, K, Rb, Cs, Fr) se vuelcan en el subgrupo de cabecera del grupo I de la Tabla D.I. Los seguidores de Mendeliev, transmitiendo fácilmente el electrón, extendiéndose al igual. Si designa charco de metal con la letra M, entonces la reacción del charco de metal con agua se puede ver de la siguiente manera: 2M + 2H 2 O → 2MOH + H 2 Los charcos eran aún más activos cuando se extendían al agua. La reacción corre turbulentamente desde la visión. Gran numero calor, no reversible y no cambia el catalizador (no catalítico) - habla, lo que acelerará la reacción y no ingresará al almacén de los productos de reacción. Significativamente, que todas las reacciones exotérmicas no cambian el catalizador y proceden irrevocablemente. Se habla de fragmentos de metal y agua, que en los distintos molinos de áridos, donde se produce la reacción entre fases, también es heterogéneo. El tipo de reacción es de sustitución. Las reacciones entre discursos inorgánicos se llevan a reacciones de sustitución, por lo que se pliega el discurso simple y se asientan otros discursos simples y plegados. (La reacción de neutralización se produce entre el ácido y la base, como resultado de lo cual el habla se intercambia con sus partes de almacén y se vuelve más fuerte y menos disociada). Como se dijo anteriormente, los exploradores lanzaron los charcos, pasando el electrón fuera de la bola exterior, y la reacción fue oxidando y oxidando. Gerente №21 De la remezcla propuesta de las infusiones de ovnishnіh, envuelva dos infusiones, como para cambiar la velocidad de la reacción de etileno con agua. Anote los números de las llamadas seleccionadas en el campo. Sugerencia: 1; 4 por sueco reacciones químicas agregue tales factores: cambiando la temperatura y la concentración de reactivos, así como la variable del catalizador. Según la regla empírica de Van't Hoff, cuando la temperatura de la piel aumenta 10 grados, la constante de uniformidad de una reacción homogénea aumenta de 2 a 4 veces. Además, cambie la temperatura para reducir la velocidad de la reacción. La primera opción es caminar. Como se marcó más arriba, se suma la velocidad de la reacción y se cambia la concentración de los reactivos: si se aumenta la concentración de etileno, entonces aumenta el crecimiento y la velocidad de la reacción, lo que no ayuda a la planta. Y un cambio en la concentración de agua: el componente activo, por otro lado, reduce la velocidad de la reacción. Además, la otra opción no es adecuada, pero la cuarta opción es adecuada. El habla es un catalizador, que acelerará la velocidad de la reacción química, pero no ingresará al almacén del producto. El cambio del catalizador acelerará la reacción de hidrogenación del etileno, lo que tampoco muestra la mente de la planta, que no es el camino correcto. Cuando el etileno interactúa con el agua (en catalizadores de Ni, Pd, Pt), el etano se disuelve: CH 2 \u003d CH 2 (g) + H 2 (g) → CH 3 -CH 3 (g) Todos los componentes que tiene la reacción y el producto son rhechovins similares a gases, además, la presión del sistema también está influenciada por la velocidad de la reacción. Por dos veces, se consume etileno, y una vez se satisface el agua, y luego, una reacción a un cambio de presión en el sistema. Presionando la presión, aceleraremos la reacción. P'yata no vino. Gerente №22 Para establecer la diferencia entre la fórmula de la sal y los productos por electrólisis de la solución acuosa de sal, como se ve en los electrodos inertes: a la posición de la piel, Fórmula de sal PRODUCTOS DE ELECTROLISIS Escriba en la tabla los números seleccionados debajo de las letras dobles. Sugerencia: 1; 4; 3; 2 La electrólisis es un proceso de oxidación y oxidación que tiene lugar en los electrodos durante el paso de una corriente eléctrica constante a través de la apertura y fusión del electrolito. En el cátodo, es importante notar la presencia de cationes tranquilos, que pueden tener la mayor actividad de óxido. En los ánodos en primer lugar, esos aniones se oxidan, como si pudieran ser el edificio más importante. electrólisis del agua 1) El proceso de electrólisis de las variaciones de agua sobre el cátodo no debe depositarse según el material del cátodo, sino según la posición del catión metálico en la serie electroquímica de voltajes. Para cationes en una fila Proceso de renovación Li+ - Al 3+: 2H 2 O + 2e → H 2 + 2OH - (H 2 se ve en el cátodo) Proceso de renovación Zn 2+ - Pb 2+: Me n + + ne → Me 0 ta 2H 2 O + 2e → H 2 + 2OH - (H 2 ta Me se puede ver en el cátodo) Proceso de renovación Cu 2+ - Au 3+ Me n + + ne → Me 0 (se ve me en el cátodo) 2) El proceso de electrólisis de las diferencias de agua en el ánodo se depositará de acuerdo con el material del ánodo y la naturaleza del anión. Al igual que el ánodo no está abierto, tobto. inerte (platino, oro, vugilla, grafito), entonces el proceso es obsoleto solo en la naturaleza de los aniones. Para aniones F -, SO 4 2-, NO 3 -, PO 4 3-, OH - proceso de oxidación: 4OH - - 4e → O 2 + 2H 2 O o 2H 2 O - 4e → O 2 + 4H + (se ve oxígeno en el ánodo) iones de haluro (crim F-) proceso de oxidación 2Hal - - 2e → Hal 2 ) orgánico proceso de oxidación de ácidos: 2RCOO - - 2e → R-R + 2CO 2 Totalmente igual a la electricidad: A) la diferencia entre Na 3 PO 4 2H 2 O → 2H 2 (en el cátodo) + O 2 (en el ánodo) B) diferencia de KCl 2KCl + 2H 2 O → H 2 (en el cátodo) + 2KOH + Cl 2 (en el ánodo) C) la diferencia entre CuBr2 CuBr 2 → Cu (en el cátodo) + Br 2 (en el ánodo) D) distribución de Cu(NO3)2 2Cu (NO 3) 2 + 2H 2 O → 2Cu (en el cátodo) + 4HNO 3 + O 2 (en el ánodo) Gerente №23 Establezca la diferencia entre el nombre de la sal y la configuración del valor de la sal a la hidrólisis: a la posición de la piel, indicada por una letra, elija la posición correcta, indicada por un número. Escriba en la tabla los números seleccionados debajo de las letras dobles. Sugerencia: 1; 3; 2; 4 Hidrólisis de sales: la interacción de sales con agua, que conduce a la adición de moléculas de agua catión H + agua a un anión de exceso de ácido y (o) grupo hidroxilo OH - moléculas de agua a un catión metálico. La hidrólisis se lleva a cabo mediante sales saturadas con cationes, que son adecuados para bases débiles, y aniones, que son adecuados para ácidos débiles. A) Cloruro de amonio (NH 4 Cl) - fuerte, hecho con ácido clorhídrico fuerte y amoníaco (base débil), sujeto a hidrólisis por catión. NH 4 Cl → NH 4 + + Cl - NH 4 + + H 2 O → NH 3 H 2 O + H + (disuelto en agua amoníaco) El medio es ácido (pH< 7). B) Sulfato de potasio (K 2 SO 4) - fuerte, hecho con ácido sulfúrico fuerte e hidróxido de potasio (prado, que es una base fuerte), no se permite la hidrólisis. K 2 SO 4 → 2K + + SO 4 2- C) Carbonato de sodio (Na 2 CO 3) - fuerza, hecho con ácido carbónico débil e hidróxido de sodio (prado, que es una base fuerte), sujeto a hidrólisis por anión. CO 3 2- + H 2 O → HCO 3 - + OH - (iluminación de un ion hidrocarbonato débilmente disociado) La parte media del charco (pH > 7). D) Sulfuro de aluminio (Al 2 S 3) - resistencia, templado con ácido sirkovodnoy débil e hidróxido de aluminio (base débil), sujeto a hidrólisis completa con hidróxido de sacarosa y sirvodnya: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 + 3H 2 S El medio está cerca de neutral (pH ~ 7). Gerente №24 Para establecer la diferencia entre reacciones químicas iguales y directamente al uso de ecualización química con presión aumentada en el sistema: a la posición de la piel, indicada por una letra, para tomar la segunda posición, indicada por un número. REACCIONES REACCIONES A) N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) B) 2H 2 (g) + O 2 (g) ↔ 2H 2 O (g) C) H 2 (g) + Cl 2 (g) ↔ 2HCl (g) D) SO 2 (g) + Cl 2 (g) ↔ SO 2 Cl 2 (g) DISEÑO DIRECTO DE QUÍMICA RIVNOVAGI 1) cambio de la reacción directa 2) zm_shchuєtsya en una reacción bik zvorotnoї 3) no hay cambio de celos Escriba en la tabla los números seleccionados debajo de las letras dobles. Testimonio: A-1; B-1; A las 3; G-1 La reacción se conoce en la proporción química, si la severidad de la reacción directa es mayor que la severidad del suero. Usunennya ryvnovagi a los necesitados alcanza directamente el cambio de opinión de la reacción. Funcionarios que firman el cargo de celos: - vicio: zbіlshennya vice zmіschuє rіvnovag at bіk reacción, scho conduce a un cambio en el volumen - temperatura: aumento de temperatura y compensación de la ecualización de la reacción endotérmica bik - concentraciones de habla externa y productos de reacción: un aumento en la concentración de hablas externas y un aumento en la concentración de productos de habla externa y un aumento en los productos de reacción de una reacción directa - Los catalizadores no escupen en la adopción de los celos, sino que aceleran el logro. A) En la primera etapa, la reacción al cambio debido a los cambios, escalando V (N 2) + 3V (H 2)\u003e 2V (NH 3). Empujando la presión sobre el sistema, es igual a vengar la matanza de los discursos menos comunes, entonces, directamente (la matanza de la reacción directa). B) De otro modo, la reacción es la misma para los cambios, las escalas son 2V (H2) + V (O2) > 2V (H2O). Empujando la presión sobre el sistema, iguale la presión sobre la reacción directa (sobre el producto). c) Al mismo tiempo, el tiempo de reacción no cambia, porque V (H 2) + V (Cl 2) \u003d 2V (HCl), no hay un sesgo igual. D) En la cuarta fase, la reacción también es igual al cambio, las escalas son V(SO2) + V(Cl2) > V(SO2Cl2). Empujando la presión sobre el sistema, igualando la presión sobre el producto (reacción directa). Gerente №25 Establezca la diferencia entre las fórmulas del habla y el reactivo, con la ayuda de la cual puede separar las diferencias de agua: a la posición de la piel, indicada por una letra, elija la posición correcta, indicada por un número. FÓRMULA DEL DISCURSO A) HNO 3 y H 2 O C) NaCl y BaCl2 D) AlCl 3 y MgCl 2 Escriba en la tabla los números seleccionados debajo de las letras dobles. Testimonio: A-1; B-3; A las 3; G-2 A) El ácido nítrico y el agua se pueden separar para obtener una sal adicional: carbonato de calcio CaCO3. El carbonato de calcio no difiere en el agua, pero cuando interactúa con el ácido nítrico, hace una diferencia en la fuerza: nitrato de calcio Ca (NO 3) 2, con el que la reacción se acompaña de visiones de dióxido de carbono desnudo: CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O B) El cloruro de potasio KCl y la pradera de NaOH se pueden separar mediante una variedad de sulfato midi (II). En la interacción del sulfato de midi (II) con KCl, la reacción de intercambio no continúa, los iones K +, Cl -, Cu 2+ y SO 4 2- están presentes en diversos grados, se disuelven poco uno con una disociación baja habla. En la interacción del sulfato de midi(II) con NaOH, se produce una reacción de intercambio que da como resultado la precipitación del hidróxido de midi(II) (la base del color de la blackita). C) Cloruro de sodio NaCl y bario BaCl 2 - sales minoristas, así como sulfato midi minorista (II). En la interacción del sulfato de midi (II) con NaCl, la reacción de intercambio no procede, los iones Na +, Cl -, Cu 2+ y SO 4 2- están presentes en diversos grados, hacen poco para disolver uno con uno bajo -Discurso de disociación. Cuando interfiere con el sulfato de midi(II) y el BaCl 2 , se produce una reacción de intercambio que da como resultado la precipitación del sulfato de bario BaSO 4 . D) El cloruro de aluminio AlCl 3 y el magnesio MgCl 2 difieren en el agua y se comportan de manera diferente cuando interactúan con el hidróxido de potasio. El cloruro de magnesio del prado pone el cerco: MgCl2 + 2KOH → Mg(OH)2 ↓ + 2KCl Al interactuar con un prado con cloruro de aluminio, se establece un precipitado, que luego difiere de la sal compleja disuelta: tetrahidroxoaluminato de potasio: AlCl3 + 4KOH → K + 3KCl Gerente №26 Establezca la posición entre el área del habla y el área de stosuvannya: a la posición de la piel, indicada por una letra, seleccione la posición correcta, indicada por un número. Escriba en la tabla los números seleccionados debajo de las letras dobles. Testimonio: A-4; B-2; A las 3; G-5 A) El ammiac es el producto más importante de la industria química, y su producción supera los 130 millones de toneladas por río. En general, el amoníaco es virulento en presencia de las añadiduras nitrogenadas (el nitrato y el sulfato de amonio, sechovin), el licor, los discursos vibuhovy, el ácido nítrico, la sosa. El medio de las variantes propuestas de vidpovidey por la esfera del estancamiento de amoníaco y el virobnitstvo dobriv (cuarta variante de vіdpovіdі). B) El metano es el carbohidrato más simple, el representante más estable térmicamente de las capas límite bajas. Yogo es ampliamente vikoristovuyut como pobutov y promislova, así como sirovini para promyslovnosti (Otra variante de vіdpovidі). Metano para 90-98% є gas natural de almacén. C) Caucho es el nombre que se le da a los materiales que se obsesionan con la polimerización con el resultado de obtener enlaces sustractivos. Izopren se puede llevar a este tipo con punto y coma y victorioso para la selección de un tipo de caucho: D) Los alquenos de bajo peso molecular son vicorados para plásticos, mientras que los vicorados de etileno son vicorados para plásticos llamados polietileno: norte CH 2 \u003d CH 2 → (-CH 2 -CH 2 -) norte Gerente No. 27 Calcular el peso de nitrato de potasio (en gramos), de la siguiente manera: en 150 g, la diferencia con una fracción de masa de sal es del 10%; para el contenido, la diferencia es con una fracción de masa del 12%. (Escriba el número a la decena más cercana). Valor: 3,4 g Explicación: Sea x g - masa de nitrato de potasio, yak rozchinyayat 150 g razchinya. Calculamos la masa de nitrato de potasio, dividida en 150 g: m(KNO 3) \u003d 150 g 0.1 \u003d 15 g Para agregar el 12% de la fracción de masa de sal, agregue x g de nitrato de potasio. Masa dobló la diferencia en tsioma (150 + x) r. Rivnyannya se escribirá a la vista: (Escriba el número a la decena más cercana). Vidpovid: 14,4 g Explicación: Como resultado del desconchado repetido del agua circulante, el dióxido de azufre y el agua se disuelven: 2H2S + 3O2 → 2SO2 + 2H2O Según la ley de Avogadro, aquellos que están obsesionados con los gases, que están en las mismas mentes, son vistos uno a uno como el número de estos gases. En este orden, para reacciones iguales: ν(O2) = 3/2ν(H2S), de ahora en adelante, obsyagi sіrkovodnya y sourness spіvvіdnosya entre ellos de esta manera: V (O 2) \u003d 3 / 2V (H 2 S), V (O 2) \u003d 3/2 6,72 l \u003d 10,08 l, estrellas V (O 2) \u003d 10,08 l / 22,4 l / mol \u003d 0,45 mol Calculemos la masa de acidez, la necesidad de un nuevo desconchado del sirkovodnya: m(O 2) \u003d 0,45 mol 32 g / mol \u003d 14,4 g Gerente №30 Vikoristovuyuchi método de equilibrio electrónico, doblar la reacción igual: Na 2 SO 3 + ... + KOH → K 2 MnO 4 + ... + H 2 O Vznachte okislyuvach y vіdnovnik. Mn +7 + 1e → Mn +6 │2 reacción de renovación S +4 − 2e → S +6 │1 reacción de oxidación Mn +7 (KMnO 4) - agente oxidante, S +4 (Na 2 SO 3) - portador Na 2 SO 3 + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O Gerente №31 Zalizo se reparó con ácido sulfúrico concentrado caliente. La fuerza de Otriman fue sobredosis con hidróxido de sodio. El asedio tormentoso de Vipav fue filtrado y frito. El discurso de Otriman fue acalorado por el frío. Escriba una lista de varias descripciones de las reacciones. 1) Zalizo, como el aluminio y el cromo, no reacciona con ácido sulfúrico concentrado, curvándose con fusión de óxido ácido. La reacción ocurre solo cuando se calienta con gas amargo: 2Fe + 6H 2 SO 4 → Fe 2 (SO 4) 2 + 3SO 2 + 6H 2 O (cuando se calienta) 2) Sulfato de solución salina (III) - soluble en agua, entra en una reacción de intercambio con el prado, como resultado de lo cual el hidróxido de saliva (III) cae en el asedio (color semimarrón): Fe 2 (SO 4 ) 3 + 3NaOH → 2Fe(OH) 3 ↓ + 3Na 2 SO 4 3) Los hidróxidos metálicos no resueltos, cuando se tuestan, se descomponen en óxidos reactivos y agua: 2Fe(OH)3 → Fe2O3 + 3H2O 4) Al calentar el óxido de carenado (III) con sal metálica, se disuelve el óxido de carenado (II) (el carenado en FeO puede tener una etapa intermedia de oxidación): Fe 2 O 3 + Fe → 3FeO (cuando se calienta) Gerente №32 Escriba reacciones iguales, con la ayuda de las cuales puede crear tal transformación: Bajo la hora de escribir reacciones iguales, fórmulas estructurales vikoristovyte de discursos orgánicos. 1) La deshidratación intramolecular ocurre a una temperatura de más de 140 o C. Como resultado, la división del átomo de agua del átomo de carbono al alcohol, ascendió a uno al hidróxido de alcohol (en la posición β). CH 3 -CH 2 -CH 2 -OH → CH 2 \u003d CH-CH 3 + H 2 O (lavado - H 2 SO 4, 180 o C) La deshidratación intermolecular se produce a temperaturas inferiores a 140 o C con ácido disulfúrico y conduce a la división de una molécula de agua en dos moléculas de alcohol. 2) Se puede agregar propileno a los alquenos asimétricos. Cuando se agregan los haluros de hidrógeno y el átomo de agua se agrega al átomo de carbono en el enlace múltiple, conectado con una gran cantidad de átomos en el agua: CH 2 \u003d CH-CH 3 + HCl → CH 3 -CHCl-CH 3 3) Con una solución acuosa de NaOH para 2-cloropropano, el átomo de halógeno se reemplaza por un grupo hidroxilo: CH 3 -CHCl-CH 3 + NaOH (ac.) → CH 3 -CHOH-CH 3 + NaCl 4) El propileno se puede eliminar no solo del propanol-1, sino también del propanol-2 mediante la reacción de deshidratación intramolecular a una temperatura superior a 140 o C: CH 3 -CH (OH) -CH 3 → CH 2 \u003d CH-CH 3 + H 2 O (lavar H 2 SO 4, 180 o C) 5) En el medio del charco, diluido con permanganato de potasio acuoso, se observa hidroxilación de alquenos con dioles aprobados: 3CH 2 \u003d CH-CH 3 + 2KMnO 4 + 4H 2 O → 3HOCH 2 -CH (OH) -CH 3 + 2MnO 2 + 2KOH Gerente №33 Fracciones de masa significativas (%) de sulfato de sal (II) y sulfuro de aluminio en suma, pero al probar 25 g de suma con agua, se observó gas, que era más probable que reaccionara con 960 g de sulfato de midi (II) al 5 %. . Debe anotar el número igual de reacciones, que se asignan a las tareas mentales, y luego agregar los cálculos necesarios (indicar las unidades de la variación de las cantidades físicas que están bromeando). Validación: ω(Al 2 S 3) = 40%; ω(CuSO4) = 60% Al procesar la suma de sulfato de sal (II) y sulfuro de aluminio con agua, el sulfato simplemente se separa y el sulfuro se hidroliza con hidróxido de aluminio (III) y agua: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 S (I) Al pasar el agua circulante por el sulfato de midi (II), cae precipitación del sulfuro de midi (II): CuSO 4 + H 2 S → CuS ↓ + H 2 SO 4 (II) Calculamos la masa y la cantidad del habla del sulfato midi(II) mixto: m (CuSO 4) \u003d m (p-ra) ω (CuSO 4) \u003d 960 g 0.05 \u003d 48 g; ν (CuSO 4) \u003d m (CuSO 4) / M (CuSO 4) \u003d 48 g / 160 g \u003d 0,3 mol Para reacciones iguales (II) ν (CuSO 4) \u003d ν (H 2 S) \u003d 0.3 mol, y para reacciones iguales (III) ν (Al 2 S 3) \u003d 1 / 3ν (H 2 S) \u003d 0, 1 mol Contemos las masas de sulfuro de aluminio y sulfato midi (II): m(Al 2 S 3) \u003d 0,1 mol 150 g / mol \u003d 15 g; m(CuSO4) = 25 g - 15 g = 10 g ω (Al 2 S 3) \u003d 15 g / 25 g 100% \u003d 60%; ω (CuSO4) \u003d 10 g / 25 g 100% \u003d 40% Gerente №34 Cuando spalyuvannі zrazka deyakoї organії ї media masa de 14,8 g tomó 35,2 g de dióxido de carbono y 18,0 g de agua. Aparentemente, la influencia de los vapores del habla es más común 37. En el curso de la investigación de los poderes químicos del habla, se ha establecido que la cetona se disuelve en la interacción del habla con el óxido midi (II). Sobre la base de estos datos, piense en la tarea: 1) calcular los números necesarios para el establecimiento de la fórmula molecular del habla orgánica (indicar las unidades de variación de las cantidades físicas que están bromeando); 2) escribir la fórmula molecular del habla orgánica; 3) sumar la fórmula estructural de la línea del habla, de modo que refleje sin ambigüedades el orden de enlace de los átomos en la primera molécula; 4) escribir la reacción igual del habla con el óxido midi(II), la fórmula estructural vicorista del habla. Se establece el resultado de ЄДІ з мії no inferior al número mínimo de bolas, lo que da derecho a ingresar a las universidades en la especialidad, los exámenes de ingreso de perelіku, la materia de química. VNZ no tiene derecho a establecer un umbral mínimo para productos químicos por debajo de 36 puntos. Las universidades prestigiosas, por regla general, establecen su propio umbral mínimo de riqueza. Es por eso que, con el fin de aprender allí, los estudiantes de primer año pueden tener más buenos conocimientos. En el sitio web oficial de la FIPI, las opciones para la DE en química están ampliamente publicadas: demostración, período previo al accidente cerebrovascular. Las mismas opciones dan una declaración sobre la estructura del sueño futuro y el nivel de plegado del día y є dzherelami información confiable cuando se prepara para ЄДІ. En las variantes de ЄDI z khіmії 2017, el año de 2017 se cambió del KІM del año pasado de 2016, por lo que era necesario prepararse para la versión actual y para el desarrollo variado de los graduados, las opciones de vikoristovuvat de los últimos años. . Materiales y posesiones adicionales Los siguientes materiales se agregan a la variante de piel del robot de examen ЄDI z chemiї: − sistema periódico de elementos químicos D.I. Mendelev; − tabla de sales, ácidos y bases en agua; − serie electroquímica de tensiones metálicas. Bajo la hora de calificar el trabajo de examen, se permite probar la calculadora sin programación. La transferencia de adiciones y materiales adicionales, que se pueden realizar en el EDI, está confirmada por orden del Ministerio de Educación de Rusia. Para aquellos que quieran continuar su formación en la universidad, una selección de asignaturas en mayo, dependiendo de la elección de las pruebas de acceso a la especialidad elegida. El cambio de los exámenes de ingreso en las universidades para todas las especialidades (formación directa) fue designado por orden del Ministerio de Educación y Ciencia de Ucrania. La piel de la prenda inicial mayor se elige de la primera transferencia de esos y otros objetos, que señalo que aceptaré en mis propias reglas. Es necesario familiarizarse con la información en los sitios web de los países seleccionados, en primer lugar, presentar una solicitud de participación en el EDI de la transferencia de los mismos sujetos.FÓRMULA DEL DISCURSO
REACTIVOS
Versión prestrokovy de ЄDI z khimiї 2017 rіk
Rik
Obtener variante de cadena previa
2017
variantepo himii
2016
Aprovechar
Versión de demostración de ЄDI z khіmії 2017
Opción zavdan + vіdpovіdі
Obtener opción de demostración
Especificación
variante de demostración himiya ege
codificador
codificador
(Preparación directa).