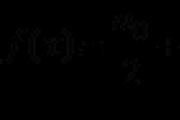Interacción de elementos químicos. "Interacción de los átomos en elementos-no metales entre sí" (grado 8)
Objetivos de la lección:
- Conoce los diferentes tipos de enlace químico.
- Repita los esquemas para hacer discursos con un tipo diferente de conexión. Sigue dando forma y anótalos en las existencias.
- Porivnyati diferentes tipos zv'azku.
Tarea de la lección:
- Cerrar la comprensión de la electronegatividad. elementos químicos, viendo un enlace covalente: polar y no polar;
- Corregir en mente plegar fórmulas estructurales electrónicas, explicando el mecanismo del establecimiento de enlaces covalentes; vikoristovuvaty nabutі znannya que vmіnnya praktіyіy dіyalnostі;
- Adoptar el desarrollo de mentes comunicativas;
- Desarrollar pensamientos lógicos.
Términos básicos:
- Rieles - todos los elementos químicos, cuyos átomos desprenden fácilmente sus propios electrones, transformándose en iones positivos.
- Nemetali - los mismos elementos químicos, cuyos átomos reciben electrones en un nivel normal, transformándose en iones negativos
- Іoni - las particulas estan cargadas, sobre las cuales el atomo se transforma despues de la entrega o aceptacion de electrones.
- electronegatividad - construir valor átomo elemento químico para atraer los electrones de otro átomo.
- sonido quimico
- el método de interacción de los átomos, que conduce al establecimiento de moléculas.
LECCIÓN OCULTA
Interacción de átomos entre elementos y no metales.
Por primera vez, adivinemos cómo se ve la tabla periódica de elementos y es visible en ella metal, no metal, metaloide. Por favor ayúdanos con la figura 1.
Mal. 1. Tabla periódica de elementos
La ominosa bola de átomos de los no metales debe vengarse de 4 a 8 electrones.
Vignatok: H (1e); Chi no (2e); (3e)
El radio de los átomos de los no metales es menor que el radio de los átomos de los metales.
Los elementos químicos no se arrojan del sistema periódico en la mazorca de los subgrupos principales, a partir del tercer grupo y los últimos períodos, tobto. en la parte superior derecha del sistema periódico. bebe 2
Mal. 2. Oztashuvannya de no metales en un sistema periódico
Poder químico de los no metales.
Los elementos químicos que no arrojan pueden actuar como oxidantes, por lo que dan poder, caen en la transformación química, en la que el hedor toma su destino.
Los átomos del elemento más electronegativo, el flúor, no dan electrones, siempre muestran solo poder oxidante, otros elementos pueden mostrar y dar poder, incluso si son más ricos en el mundo, metales más bajos. Los oxidantes más potentes son el flúor, el oxicorte y el cloro; los más importantes son el agua, el abedul, el carbón, el silicio, el fósforo, el mish'yak y el telur. Promіzhnі okislyuvalno-vіdnovі vіdnovі vіdnovnі vіdnovі vіlіvі vіstі vіtіt nitrógeno, іrka, yodo.
Interacción con discursos sencillos.
1. Interacción con metales:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
en estas vibraciones, los no metales muestran poder oxidante, los olores reciben electrones, haciendo que las partículas se carguen negativamente.
En el video podemos ver la interacción del sodio con el cloro.
2. Interacción con otros no metales:
junto con el agua, la mayoría de los no metales muestran poder oxidante, satisfaciendo los hidruros semi-covalentes del agua:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
vzaimodiyuchi con agrio, todo no arrojado, crema a flúor, muestra autoridad influyente:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
al interactuar con el flúor, el flúor se oxida y el kisen es una guía:
2F2 + O2 = 2OF2;
los no metales interactúan entre sí, el metal más electronegativo desempeña el papel de agente oxidante, el metal menos electronegativo desempeña el papel de portador:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.
Mire los enlaces covalentes polares y no polares en los pequeños. Poner las colillas de los elementos, como dárselas a los más pequeños.
Mal. 3.
Mal. 4. Enlace no polar covalente
En el video 2 puedes mirar y escuchar el enlace covalente no polar
Artículos > Química > Química grado 8agradable
Reglas para el registro de koristuvachs en el sitio "SIGN OF YAKOSTI":
El registro de koristuvachs similares a ellos está bloqueado: 111111, 123456, yutsukenb, lox і.t.p;
Defendida por reinscripción en el sitio (creando una cuenta doble);
Defender los datos de otros;
zaboronyaetsya vikoristovuvat direcciones de correo electrónico de otras personas;
Reglas de conducta en el sitio, foros y en los comentarios:
1.2. Publicación en el cuestionario de datos especiales para otros alumnos preseleccionados.
1.3. Si es o no destructivo para este recurso (scripts destructivos, recuperación de contraseña, daño al sistema de seguridad).
1.4. Vikoristannya como apodo de palabras obscenas y viraziv; vislovіv, como violar la ley Federación Rusa, normas de ética y moral; palabras y frases similares a los apodos de los administradores y moderadores.
4. Daños de 2ª categoría: Sancionados con valla nueva en la administración, si hay algún tipo de refuerzo en líneas hasta 7 deb. 4.1 Distribución de información que se rige por la ley del Código Penal de la Federación Rusa, el Código Administrativo de la Federación Rusa y la Constitución de la Federación Rusa.
4.2. Propaganda en cualquier forma de extremismo, violencia, crueldad, fascismo, nazismo, terrorismo, racismo; rozpalyuvannya interétnico, interreligioso y social vorozhnech.
4.3. Obra e imágenes incorrectamente discutidas en la dirección de los autores de los textos y notas publicadas a los costados del "FIRMA DE YAKOSTI".
4.4. Amenaza en la dirección de los participantes en el foro.
4.5. Distribución de información falsa, difamando aquellas otras declaraciones que difaman el honor y la dignidad tanto de coristuvachi como de otras personas.
4.6. Pornografía en avatares, citas y comillas, así como publicaciones en imágenes y recursos pornográficos.
4.7. Abra la discusión entre los administradores y los moderadores.
4.8. Discusión pública de esa evaluación de las reglas oficiales en cualquier forma.
5.1. Mate esa blasfemia.
5.2. Provocaciones (vipadi especial, desacreditación especial, formación de una reacción emocional negativa) y el círculo de participantes en la discusión (provocaciones sistemáticamente victoriosas de ciento cincuenta participantes).
5.3. Provocando koristuvachiv al conflicto uno por uno.
5.4. Grosería y grosería en términos de criar spivrozmovniki.
5.5. Transición a individuos y z'yasuvannya osobistih vіdnosin en el foro.
5.6. Inundación (información idéntica o no diagnosticada).
5.7. Navmisne escribió incorrectamente seudónimos y nombres de otros coristuvachs en formas figurativas.
5.8. Citas de Redaguvannya voіdomlen, scho soporuє їkh zmіst.
5.9. Publicación de un listado especial sin expresar claramente el espíritu del espía.
5.11. Trolling destructivo: el propósito de convertir una conversación en una escaramuza.
6.1. Recordatorio de sobrecitación (citas excesivas).
6.2. Fuente Vicoristannya del color rojo, reconocida por koriguvannya y respeto por los moderadores.
6.3. Discusión continua de temas cerrados por el moderador y el administrador.
6.4. Creado por aquellos que no tienen un énfasis semántico, sino que son provocadores por el simple hecho de hacerlo.
6.5. La creación del encabezamiento por temas o por las mismas letras, o muchas veces por mayúsculas, o por mi extranjero. Vinyatok para luchar por los titulares de los temas de publicación y los temas que fueron aprobados por los moderadores.
6.6. Cree una firma en una fuente más grande, reduzca la fuente de la publicación y reste una firma en más de un color de paleta.
7. Sanciones, yakі zastosovuyutsya a los infractores de las Reglas del Foro
7.1. Timchasova, o publicar una valla en el acceso al Foro.
7.4. Vista del registro de oblіkovogo.
7.5. Bloqueo de IP.
8. Notas
8.1 Las sanciones por parte de los moderadores y la administración pueden llevarse a cabo sin explicación.
8.2. Se pueden realizar cambios en estas reglas, que se informarán a todos los participantes del sitio.
8.3. Las coristuvachas son ocupadas por clones vicoristas durante el período de una hora, si el apodo principal está bloqueado. De esta forma, el clon se bloquea sin línea y el principal elimina el doba adicional.
8.4 El moderador o el administrador pueden editar las advertencias sobre lenguaje obsceno.
9. Administración La administración del sitio "SIGN OF YAKOSTI" se reserva el derecho de recibir cualquier información sin explicación. La administración del sitio se reserva el derecho de editar el perfil del corresponsal, ya que la información en ellos a menudo rompe las reglas de los foros. Los detalles se amplían a moderadores y administradores. La Administración se reserva el derecho de modificar o complementar las Reglas según sea necesario. La ignorancia de las reglas no es suficiente para la corrupción. La administración del sitio no está en condiciones de revisar toda la información para publicar el contenido. Todas las opiniones reflejan solo el pensamiento del autor, pero no pueden sino ser vikoristán para evaluar los pensamientos de todos los participantes en el foro en un instante. Informar al sitio spіvrobіtnikіv y a los moderadores є viraz їhnої osobostoї pensó y puede no tener miedo del pensamiento de los editores y del sitio kerivnitstva.
I. Clasificación de los enlaces químicos
1. Detrás del mecanismo del establecimiento de un enlace químico.
a) intercambio si daña a los átomos que hacen la conexión, dale electrones desapareados para ello.
Por ejemplo, la solución de moléculas de agua H2 y cloro Cl2:
B) donante-aceptor si uno de los átomos está listo para hacer una conexión, prepararé un par de electrones (donante), y el otro átomo vaciará el orbital vacío.
Por ejemplo, ion amonio (NH4) + (parte cargada):
2. Detrás del método de doblar orbitales electrónicos
a) σ - zv'azok (sigma) si la superposición máxima se encuentra en la línea, entonces el centro de los átomos está detrás.
Por ejemplo,
H2 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
b) π - zvyazku (no) para que la superposición máxima no se encuentre en la línea, que está detrás del centro de los átomos.
3. Detrás del camino para llegar a la carcasa electrónica completa
La piel del átomo no puede completar su nueva capa electrónica, y los medios para lograr tal objetivo pueden ser un poco.
|
Signo de alineación |
covalente |
Iona |
Metaleva |
|
|
no polar |
polar |
|||
|
¿Cómo se puede completar la carcasa electrónica? |
Salida de electrónica |
Salida de electrónica |
La transferencia de electrones, la adopción de iones (partículas cargadas) es nueva. |
Uzagalnennya elektronіv usa átomos en Cristo. ghratah |
|
¿Cómo tomar el destino de los átomos? |
nіme - nіme EO = EO |
1) Nemeth-Nemeth1 2) Met-nimet EO< ЭО |
conoció + [Nimet] - EO<< ЭО |
Los nodos tienen cationes y átomos de metal. La llamada es libre de moverse libremente en el espacio entre nodos de la electrónica. |
|
∆c= EO1 - EO2 |
< 1,7 |
> 1,7 |
||
|
Solicitar |
solo discursos - no lanzados. |
ácidos, óxidos |
sales, prados, charcos óxidos metálicos |
solo discursos - metal. Zv'yazok en metales y aleaciones, que hace vibrar electrones audiblemente fuertes entre iones metálicos en cristales metálicos. |
II. La esencia de un enlace covalente.
enlace covalente - tse link'yazyk, scho vinikaє mіzh atoms for rahunnya zagalnyh pares de electrones (por ejemplo, H2, HCl, H2O, O2).
Detrás de la etapa del desplazamiento de pares de electrones de tono alto a uno de los átomos unidos por ellos, los enlaces covalentes pueden ser polarі no polar
tercero Enlace químico covalente no polar
Enlace covalente no polar (SNC) - utvoryuyut átomos de un mismo elemento químico - no metálico(Por ejemplo, H2, O2, O3).
Mecanismo de comunicación
El átomo de la piel del no metal se ve en la corteza profunda del otro átomo del apareamiento externo de electrones. Las apuestas en línea se liquidan. El par de electrones es el mismo para ambos átomos.
Echemos un vistazo al mecanismo de disolución de la molécula de cloro: Cl2- kns.
Esquema electrónico de la disolución de la molécula de Cl2:
Fórmula estructural de la molécula de Cl2:
Cl - Cl, σ (p - p) - enlace simple
Demostración de la molécula de agua disuelta
Echemos un vistazo al mecanismo del establecimiento de la molécula agria: O2 - kns.
Esquema electrónico de la eliminación de la molécula de O2:
Fórmula estructural de la molécula de O2:
O = O
π
La molécula tiene un enlace subplegable múltiple:
Uno σ (p - p)
que uno π (p - p)
Demostración de la solubilidad de las moléculas de oxígeno y nitrógeno
IV. Zavdannya para arreglar
Zavdannya No. 1. Descubra los enlaces químicos en las moléculas de los discursos que avanzan:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Tarea 2. Escriba el mecanismo de disolución de las moléculas H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2. En el caso de un enlace covalente, se determina el tipo de superposición de partículas electrónicas (π o σ), así como el mecanismo de creación (intercambio o donante-aceptor)
Ya hemos visto cómo los átomos de los metales elementales interactúan con los átomos de los no metales elementales: algunos dan sus propios electrones y se transforman entre sí en iones positivos, otros aceptan electrones y se transforman con otros en iones negativos. Se atraen uno a uno, satisfaciendo la mitad del ion.
¿Y cómo es el vínculo entre los átomos de los elementos-no metales, cómo puedo seguir la tendencia antes de la llegada de los electrones? Fíjate en el reverso, como se forma un enlace entre los átomos de un mismo elemento químico, por ejemplo, en el habla, donde se pueden encontrar moléculas diatómicas: nitrógeno N 2, agua H 2, cloro C1 2.
Respete que para mejorar el almacén de estos discursos con la ayuda de signos químicos, también hay un índice vicario.
Dos átomos idénticos de un elemento no metálico pueden combinarse en una molécula de una sola manera: enlazando sus propios electrones, haciéndolos así comunes para ambos átomos.
Echemos un vistazo, por ejemplo, a la solución de la molécula de flúor F2.
El flúor atómico es un elemento del subgrupo principal del grupo VII (grupo VIIA) del sistema periódico de elementos químicos D.I. Mendeliev: trabaja en el nivel de energía igual a este electrón, y el átomo de la piel no llega al final de un solo electrón. Los electrones externos del átomo de flúor satisfacen tres paridades de electrones y un electrón desapareado:
Tan pronto como dos átomos se acercan entre sí, y en la piel de ellos, uno por un electrón desapareado, los electrones qi se "combinan" y se vuelven brillantes para ambos átomos, en los que se forman los extremos de la fila exterior de ocho electrones.
La solución de una molécula de flúor se muestra en el diagrama:

Cómo designar un par de electrones con un arroz, escríbalo como una fórmula estructural, por ejemplo, la fórmula estructural de una molécula de flúor
De manera similar a la molécula de flúor, la molécula diatómica de agua H 2 se disuelve:

A continuación, terminemos, el átomo de agua será una línea de dos electrones, similar a la línea completa del átomo de helio.
Fórmula estructural de la molécula de agua.
![]()
Aclaremos nuestros hallazgos sobre el enlace covalente sobre la base de la molécula de agua disuelta, comprensión vicorista de la penumbra electrónica (div. § 9). Cuando dos átomos están cerca uno del otro, que están formados por una forma esférica s-electrónica, hay una superposición de glóbulos electrónicos. Cuando echas la culpa a la zona (misce), donde la carga negativa es más alta, y por lo tanto la carga negativa puede moverse. El núcleo cargado positivamente es atraído hacia él (según el curso de la física) y la molécula se asienta. En este orden, un enlace químico es el resultado de fuerzas dieléctricas. Se puede ver claramente en el diagrama:

Es necesario señalar que en la base de la iluminación del enlace covalente, como en el caso del enlace iónico fallado, resida en la interacción de las cargas opuestas.
Al final, echemos un vistazo al algoritmo de espejo, que es necesario para escribir el esquema para iluminar un enlace covalente, por ejemplo, para una molécula de nitrógeno N 2 .
1. El nitrógeno es un elemento del subgrupo principal del grupo V (grupo VA). Los átomos de Yogo pueden cinco electrones en el plano exterior. Para determinar el número de electrones desapareados, acelere la fórmula:
8 - N = número de electrones desapareados,
de N es el número del grupo de elementos químicos.
Entonces, el átomo de nitrógeno tiene (8-5 = 3) tres electrones desapareados.
2. Escribamos los signos de los elementos químicos a partir de los signos de los electrones conocidos de tal manera que los electrones desapareados se conviertan al signo de la ley:
![]()
3. Escribamos la fórmula estructural electrónica de la molécula, que se ha establecido:
Si un átomo está unido por un solo par de electrones, dicho enlace covalente se llama simple, si dos están conectados, si es un triple, si es triple.
Cuantos más pares de electrones hay en los átomos de una molécula, más hedor está conectado uno con uno, y menos se interpone entre los núcleos de los átomos, como lo llaman un enlace doble. Para las moléculas de flúor, el enlace es simple y el enlace entre los núcleos de los átomos se convierte en 0,14 nanómetros (1 nm = 10 -9 mo 0,000000001 m). En las moléculas de nitrógeno, el enlace se pierde y la longitud del yogo se convierte en 0,11 nm. Para dividir una molécula de nitrógeno en aproximadamente una docena de átomos, es necesario triturarla aproximadamente sim veces mas energia menor para el desarrollo de enlaces simples en la molécula de flúor.
Palabras y frases clave
- Enlace químico atómico o covalente.
- Simple, subvintage y pérdida de enlaces químicos covalentes.
- Llamada Dovzhina.
- Fórmulas estructurales electrónicas.
Robot con una computadora
- Volver al programa electrónico. Lea el material para la lección y lea las instrucciones para la tarea.
- Encuentra direcciones electrónicas en Internet, que pueden ser dzherelami suplementario, cómo revelar el significado de las palabras clave y la redacción del párrafo. Pídale a su maestro que lo ayude a preparar una nueva lección, para aprender más sobre las palabras clave y frases del siguiente párrafo.
consulta y tarea
- Todos los elementos del subgrupo principal del grupo VII (grupo VIIA) del sistema Periódico de D. I. Mendeliev (subgrupos de flúor) hacen discursos simples que se componen de moléculas diatómicas. Escriba el esquema electrónico de iluminación de la fórmula estructural de tales moléculas, el signo químico vicorista para todo el subgrupo G (halógeno).
- Escriba los esquemas para el establecimiento de enlaces químicos de discursos, cuyo almacén se muestra mediante las fórmulas KC1 y C1 2.
- ¿Cuántos electrones desapareados pueden sirki los átomos? ¿Qué enlace habrá en las moléculas S2? Escriba el esquema para el establecimiento de un enlace químico en moléculas S2.
- Guarde en el orden de aumento de la cantidad de la composición química del habla con las fórmulas S 2 , Cl 2 , N 2 y encierre en un círculo la exactitud de su decisión. ¿Cómo cambias la longitud del enlace en las moléculas de la fila que has doblado?
- Divida el habla en dos grupos según el tipo de enlace químico: N2, Li2O, KS1, O2, CaF2, H2.
Asunto: Enlace covalente no polar
Gerente:
Formule una afirmación sobre un enlace covalente, un enlace covalente no polar;
Mostrar el mecanismo de establecimiento de un enlace covalente no polar;
Prodovzhit razvitok umіn analіzuvati, robiti vysnovki;
Vihovuvat cultura spіlkuvannya.
Motivación y propósito:
¿Por qué el nitrógeno y el agua existen en moléculas aparentemente diatómicas? En el proceso de rozmovi zdіysnyuєmo svіlne tsіlepokladannya que vyznaєmo el tema de la lección.
Introducción de nuevo material:
Veamos cómo se establece un enlace químico en una molécula.cl 2.
El átomo de cloro se encuentra enVIIAEl conjunto del Sistema Periódico, entonces, no tiene más que un electrón para completarse al mismo nivel de energía. Seis iguales electrónicos hacen apuestas, y uno no coincide. Dos átomos de cloro, como un electrón desapareado cada uno, se acercan, los electrones se "combinan" y se vuelven más brillantes que ambos átomos, completaremos la fila de nuestro rebaño: ocho electrones. Un par de electrones pueden ser reconocidos simplemente por el arroz.
Es por eso que el enlace covalente, pero el atómico es el mismo enlace químico, que es el culpable del resultado de la adopción de pares de electrones incandescentes.
Este enlace químico se establece entre los átomos de un mismo no metal, con la misma apuesta electrónica aguda, como si se hubieran asentado, se acuestan sobre ambos átomos en un mundo igual, y al otro lado de ellos hay no habrá carga superflua, no negativa, este enlace covalente se llama no polar.
De manera similar, la molécula de H se disuelve 2. Sin embargo, el átomo se encuentra a menudo enI Agrupo, a que el átomo de piel de agua sólo puede tener un electrón y hasta el final del viejo nivel de energía No puedo obtener suficiente de un solo electrón (supongo que para los átomos de agua y helio divididos es importante completar, como si hubiera 2 electrones en el nuevo). Un átomo de la piel puede tomar un electrón a la vez, y la cantidad de electrones desapareados se unen, satisfaciendo el par de electrones cargados, para que pueda reconocer cuán pequeñas son las imágenes.
Además, cuando dos átomos están cerca uno del otro, la piel de algunos de ellos puede ser una penumbra electrónica de forma esférica, se observa superposición de estas penumbras electrónicas. Cuando se establece un área, la carga negativa es grande, los núcleos cargados positivamente son atraídos hacia ella y se establece una molécula.

Echemos un vistazo al mecanismo de creación de una gran molécula plegable. 2 .
Kisen está enVÍAgrupo, otzhe, en mayo de 6 electrones en el mismo nivel. Y para calcular la cantidad de electrones desapareados, puede usar la fórmula 8:norte, denorte- Número de grupo. Por tanto, en el átomo de la piel habrá 2 electrones desapareados cada uno, que participarán en el enlace químico establecido. Dos electrones desapareados se fusionan con otros dos electrones desapareados del otro átomo y se hacen dos grandes apuestas de electrones, que puedes imaginar mentalmente cuando miras dos higos.
Los fragmentos de enlaces en la molécula de ácido están formados por dos pares de electrones, lo que se denomina metro, será más grande, más bajo, único, como una molécula de agua. Ale requiere comprensión, cuál es el vínculo más pequeño entre los átomos en la molécula, menor es la distancia entre los núcleos de los átomos. Tsya vіdstan se llama viejo zv'yazku. El tercer enlace todavía es corto para el aro, la cerveza es muy rica. Por ejemplo, en la molécula de nitrógeno, hay una pérdida de enlace, para dividir la molécula en dos átomos, es necesario usar mucha más energía, menos para romper un solo enlace en la molécula de cloro.
Uzagalnennya esa sistematización del conocimiento:
¿Qué enlace químico se llama covalente?
¿Entre los átomos de qué elementos se establecen enlaces covalentes no polares?
¿Cuál es la esencia del establecimiento de un enlace covalente?
¿Por qué un solo zv'yazok termina en forma de ahorcamiento y ahorcamiento?
¿Qué te mostrará el enlace y cuál es el punto de mentir?
Conocimiento de control consolidado:
Reúna los esquemas para la disolución de las moléculas del habla: a) bromo; b) flúor; c) nitrógeno.
Apague la línea de la piel:
a) CO 2 , Nueva Hampshire 3 , PAGS 4 , PAGS 2 O 5 ;
B)Cl 2 , S, N 2 , CO 2 .
Sugerencia:
a)PAGS 4 ; B)cl 2 , S, norte 2 . Cerebro con enlace covalente no polar.
Seleccionar discursos con enlace covalente no polar:
PAGS 4 , h 2 S, NH 3 , PAGS 2 O 3 , S, N 2 , oh 2 , h 2 O, HCl, H 2 .
Sugerencia: habla con una solución viscosa no polar covalente de los mismos átomos de no metales, esto seráPAGS 4 , S, norte 2 , O 2 , H 2 .
Reflexión y pidbitya pidsumkiv:
¿Cómo te importa cómo se domina el material de la lección? un bien; b) bueno; c) bastante; d) no adquirida.
¿Puedes hablarme de inmediato sobre la comida, como si la pusiéramos en la mazorca de la lección?
Tareas caseras:
Idividido: §11, ej. trece;
Yodividido: tezh + ex. 4, 5.