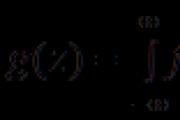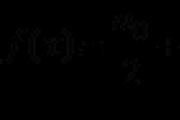Об'ємні відносини газів у хімічних реакціях. Закон Авоґадро
Газоподібний стан речовини. Закон Авогадро. Молярний об'єм газу.
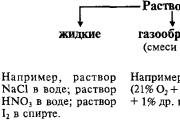
Речовини можуть перебувати в трьох агрегатних станах – твердому, рідкому та газоподібному. Частинки, у тому числі складаються тверді речовини, досить міцно пов'язані між собою, тому тверді речовини мають певну форму. Частинками твердих тіл можуть бути атоми, молекули, іони, що утворюють кристалічні структури. Ці частки коливаються з невеликою амплітудою біля вузлів кристалічних ґрат. У рідинах частинки пов'язані один з одним слабше і можуть пересуватися досить великі відстані. Тому рідини мають плинність і набувають форми судини, в якій вони знаходяться.
Перехід речовини з твердого стану рідке відбувається при нагріванні, в результаті якого амплітуда коливань частинок поступово зростає. При певній температурі частинки речовини набувають здатності залишати вузли грат, відбувається плавлення. При охолодженні, навпаки, частинки рідини втрачають здатність переміщатися і фіксуються у певному положенні, утворюючи тверду речовину. За звичайних умов рідини, як правило, мають молекулярну будову. При високій температурі структура рідини може бути й іншою (розплави солей та металів).
Взаємодія між молекулами набагато слабкіша, ніж між іонами в іонних кристалічних структурах; атомами, пов'язаними ковалентним зв'язком в атомних структурах; іонами металів, пов'язаними електронним газом у металевих структурах.
Твердий та рідкий стан речовини мають загальну назву конденсований стан. Щільності речовин у конденсованому стані перебувають у межах приблизно 0,5 – 22,5 г/см 3 . Речовини у газоподібному стані мають значно менші щільності – близько 10 –2 – 10 –3 г/см 3 . Перехід у газоподібний стан здійснюється в результаті нагрівання речовин, що знаходяться в конденсованому стані (кипіння рідин, сублімація твердих речовин). Газоподібні за звичайних умов речовини складаються з молекул.
При переході до газоподібного стану частинки речовини долають сили міжмолекулярної взаємодії. Обсяг, який займає газ, це, по суті, обсяг вільного простору між молекулами газу, що хаотично рухаються. Величина цього простору визначається температурою та тиском. При цьому обсягом, займаним самими молекулами, можна знехтувати. звідси випливає закон Авогадро :
У рівних обсягах різних газів за однакових умов міститься однакове число молекул.
Із закону Авогадро випливають два основні наслідки .
Перший слідство
Один моль будь-якого газу за однакових умов займає однаковий обсяг. Цей обсяг називається молярним обсягом газу ( V m ) , Який вимірюється в м 3 /моль (частіше в дм 3 /моль). Молярний обсяг газу дорівнює відношенню обсягу газу до його кількості:
Відомо, що величина V m залежить від умов (температура, тиск). Для вирішення завдань необхідно запам'ятати величину V m при нормальних умов (н.у.) - атмосферному тиску (101,3 кПа) та температурі танення льоду (0 0 С або 273,15 K).
За нормальних умов V m = 22,4 дм 3 /моль, або
в одиницях СІ 0,0224 м 3 /моль.
Друге слідство
Щільності газів (або маси їх однакових обсягів) ставляться між собою як молярні маси газів.
Це видно з таких міркувань. Нехай є дві порції різних газів однакового обсягу (обсяги виміряні за однакових умов). Знайдемо їх маси:
Ставлення їх мас:
Якщо використовувати щільність:
За законом Авогадро n 1 =n 2 , звідси:
Відношення щільностей газів, що дорівнює відношенню молярних мас, називається відносною щільністю одного газу по іншому ( D ). D – величина безрозмірна.
Знаючи D і молярну масу одного газу, легко знайти молярну масу іншого газу:
; M 1 = M 2 × D.
приклади
М(х) = М(Н2) × D = 2 × 8,5 = 17 г/моль
Газ із такою молярною масою – аміак NH 3 .
Щільність деякого газоподібного вуглеводню повітрям дорівнює двом. Визначте молярну масу вуглеводню.
Середня молярна маса повітря дорівнює 29 г/моль.
М(х) = М(пов.) × D = 29 × 2 = 58 г/моль
Вуглеводень з такою молярною масою - З 4 Н 10 бутан.
Слід зазначити, що гази з молярною масою менше 29 легші за повітря, більше 29 – важчі.
У розрахункових завданнях можуть бути дані відносні щільності азоту, кисню та інших газів. У цьому випадку для знаходження молярної маси необхідно помножити відносну густину на молярну масу відповідно азоту (28 г/моль), кисню (32 г/моль) і т.д.
Закон Авогадро широко застосовується у хімічних розрахунках. Оскільки для газів обсяги пропорційні кількості речовин, то коефіцієнти в рівнянні реакції, що відображають кількості реагуючих речовин, пропорційні обсягам взаємодіючих газів. Очевидно, що обсяги мають бути виміряні за однакових умов.
приклад
Який обсяг кисню буде потрібно для спалювання 2 дм 3 пропана? Обсяги виміряні за н. у.
З 3 Н 8 + 5О 2 3СО 2 + 4Н 2 О.
З закону Авогадро випливає, що рівні обсяги різних газів містять однакову кількість молекул, і, відповідно, однакову кількість моль речовин. Нехай обсяг пропану дорівнює 1 дм3. Тоді, з рівняння реакції, для спалювання 1 дм 3 пропану потрібно 5 дм 3 кисню, а 2 дм 3 (двох літрів) – 10 дм 3 Про 2 .
Хімія
Загальна хімія
Основні поняття, закони та теорії хімії
Об'ємні відносини газів у хімічних реакціях. Закон Авоґадро
Закон об'ємних відносин Гей-Люссака
Гази реагують між собою у певних об'ємних співвідношеннях. У 1808 р. Ж. Л. Гей-Люссак встановив таку закономірність: Обсяги газів, що вступають у реакцію, відносяться один до одного та газоподібних продуктів реакції як невеликі цілі числа.
Відкритий вченим закон відомий у хімії як закон об'ємних відносинь. Для його дотримання необхідно, щоб обсяги газів, що беруть участь у реакції, вимірювалися за однакових температур і тиску.
Відношення обсягів газів, що вступають у хімічну реакцію, відповідають коефіцієнтам рівняння, наприклад: .
В даному випадку 3 об'єми водню реагують з 1 об'ємом азоту, в результаті чого утворюються 2 об'єми аміаку, тобто витримується співвідношення .
Завдання. Який обсяг водню необхідний реакції з 2 м 3 азоту?
Рішення
З рівняння реакції видно, що об'єм водню повинен бути в 3 рази більший за об'єм азоту:
обсяг водню м3.
Закон Авоґадро
Для пояснення простих співвідношень між обсягами реагуючих газів використовують закон Авоґадро: У рівних обсягах різних газів за однакових умов (температура і тиск) міститься однакове число молекул.Із закону Авоґадро випливають два ніколи не давалата:
1) Один моль будь-якого газу за однакових умов займає однаковий обсяг.
За нормальних умов (н. у.), тобто при температурі 273 К та тиску 101,3 кПа (1 атм), 1 моль будь-якого газу займає об'єм, рівний 22,4 л. Цей обсяг називають молярним обсягом газуі позначають як л/моль.
Молярний обсяг можна розрахувати за формулою
.
2) При постійному тиску та температурі щільність газу визначається лише його молярною масою.
Це дозволяє запровадити поняття відносної щільностіпершого газу по другому:
,
де D- відносна щільність, яка показує, у скільки разів перший газ важчий за другий за однакових умов.
Найчастіше використовують відносну щільність газу водню. Тоді:
; .
Можна розрахувати відносну густину за будь-яким газом.
У цьому розділі використані матеріали методичного посібника"Навчання розв'язанню задач з хімії". Автори – упорядники: вчитель хімії вищої категорії, методист Установи освіти «Гімназії №1 м. Гродно» Толкач Л.Я.; методист навчально-методичного відділу Установи освіти «Гродненський ОІПК та ПРР та СВ» Коробова Н.П.
Обчислення з використанням молярного об'єму газів.
Обчислення відносної густини газів.
Об'ємні відносини газів
Один моль будь-якого газу за однакових умов займає той самий обсяг. Так, за нормальних умов (н.у.),тобто. при температурі 0 °С і нормальному атмосферному тиску, що дорівнює 101,3 кПа, один моль будь-якого газу займає об'єм22,4 дм 3 .
Ставленняобсягу газу до відповідної хімічної кількості речовини є величина, яка називаєтьсямолярним обсягом газу (V m):
V m = V/ nдм 3, звідкиV = V m · n
Для того щоб визначити: легший або важчий газ щодо іншого газу, достатньо порівняти їх щільність:
r 1 / r 2 = M 1 · V 1 / M 2 · V 2 = M 1 / M 2 = D 2.З вище наведеного виразу видно: щоб порівняти щільності газів, досить порівняти їх молярні маси.
Відношення молярної маси одного газу до молярної маси іншого газу є величина, яка називається
відносною щільністю ( D 2 ) одного газу з іншого газу.Знаючи відносну щільність одного газу по іншому, можна визначити його молярну масу:
M
1 = M 2 · D 2 .Повітря є сумішшю газів, тому його «молярна маса» є масою повітря об'ємом 22,4 л. Ця величина чисельно дорівнює:
М пов. = 29 г/моль
Відповідно до закону Авогадро однакове число молекул різних газів за тих самих умов займає однаковий обсяг.
Із цього випливає друге слідство.
При постійних температурі і тиску обсяги вступають у реакцію газів відносяться один до одного, а також до обсягів газоподібних продуктів, що утворюються, як невеликі цілі числа.
Ця закономірність була сформульована Гей-Люссаком як закону об'ємних відносин газів. Таким чином, якщо у хімічній реакції беруть участь або виходять газоподібні речовини, то за рівнянням реакції можна встановити об'ємні відносини.
Обсяги газів, що реагують та одержуються, пропорційні хімічним кількостям цих речовин:
V 1 / V 2 = n 1 / n 2 тобто. V 1 та V 2
чисельно рівні коефіцієнтів у рівнянні реакції.приклад 1. Балон вміщує 0,5 кг стисненого водню. Який об'ємзайме таку кількість водню? Умовинормальні.
Рішення:
1. Обчислюємо хімічну кількість
водню, що міститься в балоні:N
(Н 2) = 500/2 = 250 (моль), де М(Н 2) = 2 г/моль.2.Оскільки за нормальних умов 1 моль будь-якого газу займає обсяг 22,4
дм 3 , тоV = V m · n, V( H 2 ) = 22,4 * 250 = 5600 (дм 3)
Відповідь: 5600 дм 3
Приклад2. Який склад (в %) алюмінієво-мідного сплаву, якщо при обробці 1 г надлишком його соляної кислоти виділилося 1,18 лводню?
Рішення:
1.Оскільки в реакцію з кислотою вступить тільки алюміній, тозаписуємо рівняння:
2А1 + 6НС1 = 2А1С1 3 + 3H 2
2моль 3 моль
2.Обчислюємо хімічна кількістьводню:
n(Н 2 ) = 1.18/22.4 = 0,05 (моль)
3.По рівнянню реакції обчислюємо масу алюмінію,що міститься в сплаві:
3 моль 2 моль алюмінію
0,05 моль водню виділиться, якщо прореагуєxмоль алюмінію
х = 0.05 · 2/3 = 0,033 (моль),
m( Al) = 0,035 · 27 = 0,9 (г), де М(Аl) = 27 г/моль
5. Обчислюємо масову частку алюмінію в металі:
w(Аl) = m ( Al ) / m (Сплаву) , w( А1) = 0,9/1 = 0,9 чи 90%.
Тоді масова частка міді у сплаві 10%
Відповідь: 90% алюмінію, 10% міді
приклад 3. Визначити відносну щільність: а) кисню повітрям,б) вуглекислого газу водню.
Рішення:
1. Знаходимо відносну щільність кисню повітрям:
D повіт (Про 2) =M(Про 2)/M (пов.) = 32/29= 1,1.
2.Визначаємо відносну щільність вуглекислого газу поводню
D Н2 (СО 2) =M(З 2 )/M(Н 2) = 44/2 = 22.
Відповідь: 1,1; 22
приклад 4. Визначте об'єм суміші газів, що складається з 0,5 моль кисню, 0,5 моль воднюта 0,5 моль вуглекислого газу.
Рішення:
1. Знаходимо хімічну кількість суміші газів:
n(суміші) = 0,5 + 0,5 + 0,5 = 1,5 (моль).
2. Обчислюємо обсяг суміші газів:
V(суміші) = 22,4 · 1,5 = 33,6 (дм 3).
Відповідь: 33,6 дм 3 суміші
Приклад 5. Розрахуйте об'єм вуглекислого газу, що вийде при спалюванні 11,2 м 3 метану СН 4 .
Рішення:
1. Записуємо рівняння хімічної реакції горіння метану:
CH 4 + 2O 2 = CO 2 + 2H 2 O
1 моль1 моль
1 м 3 1 м 3
2. Для обчислення обсягу вуглекислого газу складаємо та вирішуємо пропорцію:
при спалюванні 1 м 3 СН 4 вийде 1 м 3 2
при спалюванні 11,2 м 3 СН 4 вийде х м 3 2
х = 11,2 · 1/1 = 11,2 (м 3 )
Відповідь: 11,2 м 3 вуглекислого газу
Приклад 6. Сталевий балон для зберігання стиснутих газів заповнили рідким киснем масою 8 кг.
Який обсяг займе кисень у газоподібному стані (н.у.)?
Рішення:
1. Обчислюємо хімічну кількість рідкого кисню:
n( O 2 ) = 8000/32 = 250 (моль).
2. Обчислюємо обсяг газоподібного кисню:
V( O 2 ) = 22, 4 · 250 = 5600 дм 3 .
Відповідь: 5600 дм 3
Приклад 7. Обчисліть масу повітря об'ємом 1 м 3 (н.у.), якщо в ньому 78 об'ємних часток азоту, 21 - кисню, 1 - аргону (крім інших газів).
Рішення:
1. Виходячи з умови завдання, обсяги газів у повітрі відповідно дорівнюють:
V( N 2 ) = 1 · 0,78 = 0,78 м 3 ;
V(Про 2) = 1 · 0,21 = 0,21 м 3
V(Аr) = 1 · 0,01 = 0,01 м 3 .
2. Обчислюємо хімічну кількість кожного газу:
n( N 2 ) = 0,78/22,4 · 10 -3 = 34,8 (моль),
n(Про 2) = 0,21/22,4 · 10 -3 = 9,4 (моль),
n(Аr) = 0,01/22,4 · 10 -3 = 0,45 (моль).
3. Обчислюємо маси газів:
m(N 2 ) = 34,8 · 28 = 974 (г),
m(Про 2 ) = 9,4 · 32 = 30 (г),
m(Аr) = 0,45 · 40 = 18 (г).
4. Обчислюємо масу повітря:
m(Повітря) = 974 + 301 + 18 = 1293 (г) або 1,293 кг.
Відповідь: 1,293 кг повітря
Приклад 8. При підпалюванні в евдіометрі суміші кисню та водню об'ємом 0,1 м 3 об'єм суміші зменшився на 0,09 м 3 .
Які обсягиводню і кисню були у вихідній суміші, якщо газ, що залишився, горить (н.у.) ?
Рішення:
1. Записуємо рівняння реакції:
2Н 2 + Про 2 = 2Н 2 Про
2 моль 1моль 2моль
2. Визначаємо обсяги газів, що вступили у реакцію.
обсяг газової суміші скоротився за рахунок утворення рідкої води, тому обсяг газів, що вступили в реакцію, дорівнює 0,09 м 3 .
Т.к. гази вступають у реакцію щодо 2:1, то з 0,09 м 3 дві частини
припадають на водень, а одна – на кисень. Отже, у реакцію
вступило 0,06 м 3 водню та 0,03 м 3 кисню.
3. Обчислюємо обсяги газів у вихідній суміші.
Т.к. газ, що залишився, горить, то це водень – 0,01 м 3 .
V(Н 2 ) = 0,01 + 0,06 = 0,07 (м 3 ) або 70 л,
V(Про 2 ) = 0,1 - 0,07 = 0,03 (м 3 ) або 30 л.
Відповідь: 70 л водню, 30 л кисню
Приклад 9. Визначте щільність водню газової суміші, що складається з 56л аргону і 28 л азоту (н.у.) ?
Рішення:
1. Виходячи з визначення відносної густини газів,
D H 2 = M (суміші) / M(H 2 ).
2. Обчислюємо хімічну кількість та масу суміші газів:
n(Ar) = 5.6/22.4 = 2,5 (моль);
n(N 2 ) = 28/22.4 = 1,25 (моль);
n(суміші) = 2,5 + 1,25 = 3,75 (моль).
m(Ar) = 2,5 · 40 = 100 (г),
m(N 2 ) = 1,25 · 28 = 35 (г),
m(суміші) = 100 + 35 = 135 (г), т.к.
М (Аr) = 40 г/моль, М (N 2 ) = 28 г/моль.
3. Обчислюємо молярну масу суміші:
М(суміші) = m (суміші) / n (суміші) ;
М(суміші) = 135/3,75 = 36 (г/моль)
4. Обчислюємо відносну щільність суміші газів воднем:
D H 2 = 36/2 = 18.
Відповідь: 18
приклад 10. Чи можна повністю спалити 3 г деревного вугілля у трилітровій банці, наповненій киснем (н.у.)?
Рішення:
1. Записуємо рівняння реакції горіння вугілля:
З + Про 2 = СО 2
1моль 1моль
2. Обчислюємо хімічну кількість вугілля:
n(С) = 3/12 = 0,25 (моль), тому що М (С) = 12 г/моль.
Хімічна кількість кисню, необхідного для реакції, буде також рівна 0,25 моль (виходячи з рівняння реакції).
3. Обчислюємо об'єм кисню, необхідний для спалювання 3 г вугілля:
V(O 2 ) = 0,25 · 22,4 = 5,6(л).
4. Оскільки газ займає об'єм судини, в якій він знаходиться, є 3 л кисню. Отже, цієї кількості не вистачить для спалювання 3 г вугілля.
Відповідь: не вистачить
приклад 11. У скільки разів збільшиться об'єм рідкої води внаслідок перетворення її на пару при н.у.?
Для хімічної реакції aA + bB = cC + dD
виконується співвідношення
де nА і nВ – кількості вихідних речовин, що вступили в реакцію, пС і nD – кількості продуктів, що утворилися, а, b, с і d – стехіометричні коефіцієнти.
Від кількості речовин легко перейти до їх мас:
Для газоподібних речовин частіше задають чи визначають їх обсяги. Якщо реагент і продукт D – гази, то проводять перехід від кількостей цих речовин до їх обсягів:
![]()
За відомих (за умовою) кількості, маси або обсягу (для газу) однієї з речовин, що беруть участь в реакції, можна розрахувати значення всіх величин для інших речовин.
У разі суміші газів А і В, один з яких бере участь у реакції, можна знайти взяте співвідношення їх обсягів VA: VB, а при заданому співвідношенні – їх обсяг суміші (або навпаки).
Приклад розв'язання задачі
При високій температурі магній реагує з азотом, взятим у вигляді суміші з аргоном, загальним об'ємом 5,6 л (н.у.) і утворює 15 г нітриду. Розрахуйте об'ємне відношення газів V(N2): V(Ar) у вихідній суміші.


Завдання для самостійного рішеннячастини А
1. Прореагувало 6 л оксиду азоту (II) з 5 л кисню (обсяги виміряні за рівних умов), отже, в кінцевій суміші об'ємне відношення продукту до одного з реагентів одно
2. У замкнутій посудині спалили 24 г графіту в 67,2 л (н. у.) кисню та отримали об'ємне відношення кисень: продукт рівним
3. Пропустили через озонатор 7,5 моль кисню, який частково перетворився на озон. Останній повністю витрачений на «спалювання» (за нормальних умов) 0,5 моль сірководню (перетворюється на SO2); отже, об'ємне відношення O3: O2 на виході з озонатора становило
4. Бромід калію масою 142,8 г прореагував кількісно в розчині з хлором, взятим у вигляді суміші з повітрям в об'ємному відношенні 1 (хлор): 2 (повітря). Загальний обсяг (у літрах) вихідної суміші газів був
5. Для повного згоряння 17,92 л (н.у.) суміші СН4 + Н2 знадобився 1 моль кисню. У вихідній суміші об'ємне відношення СН4: Н2 дорівнює:
6. Газ А, отриманий при прожарюванні 0,04 моль КClO3 на каталізаторі, змішали (при н. у.) у посудині з газом Б, що виділився при обробці 6 г кальцію водою, і отримали суміш з об'ємним відношенням А: Б, рівним
7. Після спалювання нітробензолу в надлишку кисню отримана суміш продуктів (азот, вуглекислий газ, вода), в якій міститься 4 л (н. у.) азоту, а об'ємне відношення N2: O2 дорівнює 4: 1. у літрах, н. у.) кисню становив
8. Проведено термічне розкладання 1 моль хлориду амонію в сталевому балоні, що вже містив 11,2 л (н. у.) аміаку. Кінцеве об'ємне відношення NH3: НCl дорівнює
9. Суміш кисню та хлору з об'ємним відношенням 9: 1 використана для виділення 0,5 моль простої речовини з розчину KI, отже, загальний обсяг (у літрах, н. у.) витраченої суміші газів дорівнює
10. Через озонатор пропустили кисень, отриманий при прожарюванні 1 моль КClO3 на каталізаторі, при цьому 5% кисню перетворилося на озон і на виході з озонатора об'ємне відношення O2: O3 склало
Фізико-хімічні закономірності формування тонкоплівкових металополімерних систем із газової фази
Тонкоплівкові металополімерні матеріали (металізовані полімери, металеві вироби з тонким полімерним покриттям, багатошарові системи та ін.), що формуються методами вакуумної техніки.
Епітаксіальне зростання Ge на поверхні Si(100)
З фізикою тонких плівок пов'язані досягнення та перспективи подальшого розвитку мікроелектроніки, оптики, приладобудування та інших галузей нової техніки. Успіхи мікромініатюризації електрон...
Компоненти, що мають властивості знижувати горючість полімерних матеріалів
Щороку пожежі завдають економіці країни збитків у сотні мільйонів рублів. При згорянні полімерних матеріалів виділяється велика кількістьтоксичних газів, що згубно діють на людину і...
Цілі уроку:
Перегляд вмісту документа
«Хімія 9 клас Об'ємні відносини газів у хімічних реакціях. Обчислення об'ємних співвідношень газів за хімічними рівняннями.
Урок хімії на тему «Об'ємні відносини газів у хімічних реакціях. Обчислення об'ємних співвідношень газів за хімічними рівняннями»
Урок № 3 за методикою критичного мислення
Цілі уроку:формувати знання учнів про закон об'ємних відносин для газоподібних речовин з прикладу хімічних реакцій органічних речовин; формувати вміння застосовувати закон об'ємних співвідношень для розрахунків із хімічних рівнянь. Удосконалювати вміння учнів вирішувати розрахункові завдання щодо рівнянь хімічних реакцій. Розвивати вміння учнів складати хімічні завдання. Розвивати критичне мислення. Формувати позитивне ставлення до вивчення предмета, сумлінне ставлення до виконуваного завдання.
Обладнання:картки-завдання.
Хід уроку.
I.Розминка(Учні залучаються до висловлювання своїх думок)
А. Франс «Коли людина мислить, вона має сумнів, але вона впевнена, коли…»
Як би ви закінчили цю фразу?
Учні працюють у групах. Записують запропоновані варіанти. Вибирають ті, які на їхню думку підходять більше.
Висновок: «Коли людина мислить, вона має сумнів, але вона впевнена, коли діє».
Я сподіваюся, що справа, якою ми займатимемося на уроці, вас зацікавить і ви виявите свої здібності та вміння.
ІІ. Мотивація пізнавальної діяльності.
Оголошення теми та завдань уроку.
Ш. Ступінь актуалізації
За діаграмою Відень згадати хімічні властивості алкенів та алкінів.
Чому дорівнює молярний обсягбудь-якого газу за н.у.
Відповідь: 22,4 л/моль
Як формулюється закон Авогадро?
Відповідь:У однакових обсягах різних газів за однакових умов (t,p) міститься однакове число молекул.
Висновок:обсяги газоподібних реагентів та продуктів реакції співвідносяться як їх коефіцієнти в рівняннях реакції. Ця закономірність використовується для хімічних розрахунків.
Творче завдання:(Дає можливість переконатися у стійких знаннях учнів на тему)
У трьох пронумерованих пробірках, закритих пробками, є: метан, етилен, ацетилен. Як розпізнати, де який газ знаходиться?
IV. Ступінь усвідомлення(Доведення до свідомості учнів матеріалу, що спирається на проблемність, пошук істини).
Посилена лекція («Карусель»: спочатку даються основні поняття щодо вирішення завдань; після закінчення учні об'єднуються в пари, вирішують подібні завдання; складають подібні завдання, які вирішує сусідня пара і т.д.)
Об'єм хлору (н.у.), який вступить у реакцію з 7 л пропену, дорівнює:
а) 14 л; б) 10 л; в) 7 л; г) 22,4 л.
3. Обчислити обсяг повітря, який знадобиться для спалювання суміші,
яка складається з 5 л етилену та 7 л ацетилену (н.у.).
Вкажіть, який об'єм водню необхідний для повного гідрування 7 л етилену відповідно до рівняння реакції:
З 2 Н 4 + Н 2 = З 2 Н 6 а) 7 л; б) 6 л; в) 14 л; г) 3,5 л.
Робота у парах.Учні, об'єднавшись у пари, складають подібні завдання, які вирішує сусідня пара:
Об'єм водню, необхідний для повного гідрування 15 л бутину, дорівнює: а) 15 л; б) 30 л; в) 7,5 л; г) 3,5 л.
Який об'єм хлору приєднається до 5 л ацетилену відповідно до рівняння реакції С 2 Н 2 + 2Cl 2 = С 2 Н 2 Cl 2
а) 5 л; б) 10 л; в) 2,5 л; г) 22,4 л.
3. Обчислити обсяг повітря, яке необхідно витратити на спалювання
10 м3 ацетилену (н.у.).
V. Рефлексія
Виконання завдання з картки.
Обчислити обсяг водню, необхідний повного гідрування речовини Х.
(Учні самостійно заповнюють таблицю, після закінчення роботи звіряють відповіді).
| Обсяг речовини Х,л | Формула речовини Х | Рівняння гідрування | водню,л |
|
VІ . Висновки з уроку
Формулюються завдання наступного уроку.
VІ I. Підсумки уроку
VIII. Домашнє завдання
Пропрацювати параграф 23, виконати вправи 206, 207 на стор.