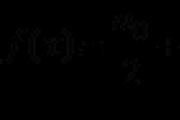Взаємодія хімічних елементів. "Взаємодія атомів елементів-неметалів між собою" (8 клас)
Цілі уроку:
- Узагальнити відомості про різні типи хімічного зв'язку.
- Повторити схеми утворення речовин з різним типом зв'язку. Продовжити формування вміння записувати їх на прикладах.
- Порівняти різні типизв'язку.
Завдання уроку:
- Закріпити поняття електронегативності хімічних елементів, видів ковалентного зв'язку: полярного та неполярного;
- Вправляти в умінні складати електронні, структурні формули сполук, пояснювати механізм утворення ковалентних зв'язків; використовувати набуті знання та вміння у практичній діяльності;
- Сприяти розвитку комунікативних умінь;
- Розвивати логічне мислення.
Основні терміни:
- Метали - це хімічні елементи, атоми яких легко віддають свої зовнішні електрони, перетворюючись на позитивні іони.
- Неметали - це хімічні елементи, атоми яких приймають електрони на зовнішній рівень, перетворюючись на негативні іони
- Іони - заряджені частинки, на які перетворюється атом після віддачі або прийняття електронів.
- Електронегативність - це здатність атомахімічного елемента притягувати себе електрони іншого атома.
- Хімічний зв'язок
- це спосіб взаємодії атомів, що веде до утворення молекул.
ХІД УРОКУ
Взаємодія атомів елементів-неметалів між собою
Для початку давайте згадаємо, як виглядає періодична таблиця елементів, і виділимо в ній метали, неметали, металоїди. Допоможе нам у цьому рисунок 1.
Мал. 1. Періодична таблиця елементів
Зовнішній шар атомів неметалів містить від 4 до 8 електронів.
Виняток: Н (1e); Чи не (2e); (3e)
Радіус атомів неметалів менший за радіус атомів металів.
Хімічні елементи неметали перебувають у періодичної системі початку головних підгруп, починаючи з третьої групи і кінці періодів, тобто. у правій верхній частині періодичної системи. Малюнок 2.
Мал. 2. Розташування неметалів у періодичній системі
Хімічні властивості неметалів
Хімічні елементи-неметали можуть виявляти як окисні, так і відновлювальні властивості, залежно від хімічного перетворення, в якому вони беруть участь.
Атоми самого електронегативного елемента – фтору – не здатні віддавати електрони, він завжди виявляє лише окислювальні властивості, інші елементи можуть виявляти і відновлювальні властивості, хоча набагато меншою мірою, ніж метали. Найбільш сильними окислювачами є фтор, кисень і хлор, переважно відновлювальні властивості виявляють водень, бір, вуглець, кремній, фосфор, миш'як та телур. Проміжні окислювально-відновні властивості мають азот, сірка, йод.
Взаємодія з простими речовинами
1. Взаємодія з металами:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
у цих випадках неметали виявляють окислювальні властивості, вони приймають електрони, утворюючи негативно заряджені частинки.
На відео ми можемо переглянути взаємодію натрію з хлором
2. Взаємодія з іншими неметалами:
взаємодіючи з воднем, більшість неметалів виявляє окислювальні властивості, утворюючи леткі водневі сполуки – ковалентні гідриди:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
взаємодіючи з киснем, всі неметали, крім фтору, виявляють відновлювальні властивості:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
при взаємодії з фтором фтор є окислювачем, а кисень – відновником:
2F2 + O2 = 2OF2;
неметали взаємодіють між собою, більш електронегативний метал грає роль окислювача, менш електронегативний - роль відновника:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.
На малюнках розгляньте ковалентний полярний і неполярний зв'язок. Наведіть приклади елементів, які відповідають цим малюнкам.
Мал. 3.
Мал. 4. Ковалентний неполярний зв'язок
На відео 2 Ви зможете переглянути та прослухати ковалентний неполярний зв'язок
Предмети > Хімія > Хімія 8 класУгода
Правила реєстрації користувачів на сайті "ЗНАК ЯКОСТІ":
Забороняється реєстрація користувачів з ними подібними: 111111, 123456, йцукенб, lox і.т.п;
Забороняється повторно реєструватися на сайті (створювати дубль-акаунти);
Забороняється використовувати чужі дані;
Забороняється використовувати чужі e-mail адреси;
Правила поведінки на сайті, форумі та в коментарях:
1.2. Публікація в анкеті особистих даних для інших користувачів.
1.3. Будь-які деструктивні дії щодо даного ресурсу (деструктивні скрипти, підбір паролів, порушення системи безпеки тощо).
1.4. Використання як нікнейм нецензурних слів та виразів; висловів, які порушують закони Російської Федерації, норми етики та моралі; слів і фраз, схожих на нікнейми адміністрації та модераторів.
4. Порушення 2-ї категорії: Караються повною забороною на відправлення будь-яких видів повідомлень на строк до 7 діб. 4.1.Розміщення інформації, що підпадає під дію Кримінального Кодексу РФ, Адміністративного Кодексу РФ та суперечить Конституції РФ.
4.2. Пропаганда у будь-якій формі екстремізму, насильства, жорстокості, фашизму, нацизму, тероризму, расизму; розпалювання міжнаціональної, міжрелігійної та соціальної ворожнечі.
4.3. Некоректне обговорення роботи та образи на адресу авторів текстів та нотаток, опублікованих на сторінках "ЗНАК ЯКОСТІ".
4.4. Загрози на адресу учасників форуму.
4.5. Розміщення свідомо неправдивої інформації, наклепів та інших відомостей, що ганьблять честь і гідність як користувачів, так і інших людей.
4.6. Порнографія в аватарах, повідомленнях та цитатах, а також посилання на порнографічні зображення та ресурси.
4.7. Відкрите обговорення дій адміністрації та модераторів.
4.8. Публічне обговорення та оцінка чинних правил у будь-якій формі.
5.1. Мат та ненормативна лексика.
5.2. Провокації (особисті випади, особиста дискредитація, формування негативної емоційної реакції) та цькування учасників обговорень (систематичне використання провокацій стосовно одного чи кількох учасників).
5.3. Провокування користувачів на конфлікт один з одним.
5.4. Грубість та хамство по відношенню до співрозмовників.
5.5. Перехід на особи та з'ясування особистих відносин на гілках форуму.
5.6. Флуд (ідентичні або беззмістовні повідомлення).
5.7. Навмисне неправильне написання псевдонімів та імен інших користувачів у образливій формі.
5.8. Редагування цитованих повідомлень, що спотворює їх зміст.
5.9. Публікація особистого листування без явно вираженої згоди співрозмовника.
5.11. Деструктивний тролінг - цілеспрямоване перетворення обговорення на перепалку.
6.1. Оверквотинг (надлишкове цитування) повідомлень.
6.2. Використання шрифту червоного кольору, призначеного для коригування та зауважень модераторів.
6.3. Продовження обговорення тем, закритих модератором чи адміністратором.
6.4. Створення тем, які не несуть смислового наповнення або є провокаційними за змістом.
6.5. Створення заголовка теми або повідомлення повністю або частково великими літерами або на іноземною мовою. Виняток робиться для заголовків постійних тем і тем, відкритих модераторами.
6.6. Створення підпису шрифтом більшим, ніж шрифт посту, і використання підпису більше одного кольору палітри.
7. Санкції, які застосовуються до порушників Правил Форуму
7.1. Тимчасова або постійна заборона доступу до Форуму.
7.4. Видалення облікового запису.
7.5. Блокування ІР.
8. Примітки
8.1.Застосування санкцій модераторами та адміністрацією може проводитись без пояснення причин.
8.2. В ці правила можуть бути внесені зміни, про що буде повідомлено всім учасникам сайту.
8.3. Користувачам забороняється використовувати клони в період часу, коли заблоковано основний нік. У цьому випадку клон блокується безстроково, а основний нік отримає додаткову добу.
8.4 Повідомлення, що містить нецензурну лексику, може бути редаговано модератором або адміністратором.
9. Адміністрація Адміністрація сайту "ЗНАК ЯКОСТІ" залишає за собою право видалення будь-яких повідомлень і без пояснення причин. Адміністрація сайту залишає за собою право редагувати повідомлення та профіль користувача, якщо інформація в них лише частково порушує правила форумів. Дані повноваження поширюються на модераторів та адміністраторів. Адміністрація зберігає за собою право змінювати або доповнювати ці Правила за необхідності. Незнання правил не звільняє користувача від відповідальності за порушення. Адміністрація сайту не в змозі перевіряти всю інформацію, яку публікують користувачі. Всі повідомлення відображають лише думку автора та не можуть бути використані для оцінки думки всіх учасників форуму загалом. Повідомлення співробітників сайту та модераторів є виразом їхньої особистої думки і можуть не збігатися з думкою редакції та керівництва сайту.
I. Класифікація хімічних зв'язків
1. За механізмом утворення хімічного зв'язку
а) обміннийколи обидва атоми, що утворюють зв'язок, надають для неї неспарені електрони.
Наприклад, утворення молекул водню Н2 та хлору Cl2:
б) донорно-акцепторний коли один з атомів надає для утворення зв'язку готову пару електронів (донор), а другий атом - порожню вільну орбіталь.
Наприклад, утворення іону амонію (NH4)+ (заряджена частка):
2. За способом перекривання електронних орбіталей
а) σ - зв'язок (сигма)коли максимум перекривання лежить на лінії, що з'єднує центри атомів.
Наприклад,
H2 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
б) π - зв'язку (пі)якщо максимум перекривання не лежить на лінії, що з'єднує центри атомів.
3. За способом досягнення завершеної електронної оболонки
Кожен атом прагне завершити свою зовнішню електронну оболонку, причому способів досягнення такого стану може бути кілька.
|
Ознака порівняння |
Ковалентна |
Іонна |
Металева |
|
|
неполярна |
полярна |
|||
|
Як досягається завершена електронна оболонка? |
Узагальнення електронів |
Узагальнення електронів |
Повна передача електронів, утворення іонів (заряджених частинок). |
Узагальнення електронів усіма атомами в христ. ґратах |
|
Які беруть участь атоми? |
німе - німе ЕО = ЕО |
1) Немет-Немет1 2)Мет-німет ЕО< ЭО |
мет + [Німет] - ЕО<< ЭО |
У вузлах знаходяться катіони та атоми металу. Зв'язок здійснюють вільно переміщуються в міжвузловому просторі електрони. |
|
∆c= ЕО1 - ЕО2 |
< 1,7 |
> 1,7 |
||
|
Приклади |
прості речовини – неметали. |
кислоти, оксиди |
солі, луги, оксиди лужних металів |
прості речовини – метали. Зв'язок у металах і сплавах, який виконують відносно вільні електрони між іонами металів у металевих кристалічних ґратах. |
ІІ. Сутність ковалентного зв'язку
Ковалентний зв'язок -це зв'язок, що виникає між атомами за рахунок утворення загальних електронних пар (наприклад, H2, HCl, H2O, O2).
За ступенем зміщення загальних електронних пар до одного із зв'язаних ними атомів ковалентний зв'язок може бути полярнийі неполярний.
ІІІ. Ковалентний неполярний хімічний зв'язок
Ковалентний неполярний зв'язок (КНС) - утворюють атоми одного і того ж хімічного елемента – неметала(Наприклад, H2, O2, О3).
Механізм освіти зв'язку
Кожен атом неметалу віддає в загальне користування іншому атому зовнішні спарені електрони. Утворюються загальні електронні пари. Електронна пара належить однаково обом атомам.
Розглянемо механізм утворення молекули хлору: Cl2- кнс.
Електронна схема утворення молекули Cl2:
Структурна формула молекули Cl2:
Cl - Cl , σ (p - p) - одинарний зв'язок
Демонстрація утворення молекули водню
Розглянемо механізм утворення молекули кисню: О2 – кнс.
Електронна схема утворення молекули О2:
Структурна формула молекули О2:
О = О
π
У молекулі кратний, подвійний зв'язок:
Одна σ (p - p)
та одна π (р - р)
Демонстрація утворення молекул кисню та азоту
IV. Завдання для закріплення
Завдання №1. Визначте види хімічних зв'язків у молекулах наступних речовин:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Завдання №2. Напишіть механізм утворення молекул H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2. У разі ковалентного зв'язку визначте тип перекривання електронних хмар (π або σ), а також механізм утворення (обмінний або донорно-акцепторний)
Ми вже розглянули, як взаємодіють атоми елементів-металів з атомами елементів-неметалів: одні віддають свої зовнішні електрони і перетворюються при цьому на позитивні іони, інші приймають електрони і перетворюються при цьому на негативні іони. Іони притягуються одна до одної, утворюючи іонні сполуки.
А як здійснюється зв'язок між атомами елементів-неметалів, які мають схожу тенденцію до приєднання електронів? Розглянемо спочатку, як здійснюється зв'язок між атомами одного й того ж хімічного елемента, наприклад, у речовинах, що мають двоатомні молекули: азоту N 2 , водню Н 2 , хлору С1 2 .
Зауважте, що для відображення складу цих речовин за допомогою хімічних знаків також використовують індекси.
Два однакових атома елемента-неметалу можуть об'єднуватися в молекулу тільки одним способом: узагальнивши свої зовнішні електрони, тобто зробивши їх загальними для обох атомів.
Розглянемо, наприклад, утворення молекули фтору F2.
Атоми фтору – елемента головної підгрупи VII групи (VIIA групи) Періодичної системи хімічних елементів Д. І. Менделєєва – мають на зовнішньому енергетичному рівні сім електронів, і кожному атому не вистачає до його завершення лише одного електрона. Зовнішні електрони атома фтору утворюють три електронні пари та один непарний електрон:
Якщо зближуються два атоми і в кожного з них є по одному зовнішньому неспареному електрону, то ці електрони «об'єднуються» і стають загальними для обох атомів, у яких сформується завершений зовнішній восьмиелектронний рівень.
Утворення молекули фтору зображено на схемі:

Якщо позначити загальну електронну пару рисочкою, запис називають структурною формулою, наприклад структурна формула молекули фтору
Аналогічно молекулі фтору утворюється двоатомна молекула водню Н 2:

Слід врахувати, що завершеним для атома водню буде двоелектронний рівень, подібний до завершеного рівня атома гелію.
Структурна формула молекули водню
![]()
Уточнимо наші уявлення про ковалентний зв'язок на прикладі утворення молекули водню, використовуючи поняття електронної хмари (див. § 9). При зближенні двох атомів водню, що мають по одній s-електронній хмарі сферичної форми, відбувається перекриття електронних хмар. При цьому виникає область (місце), де щільність негативного заряду найбільш висока і тому має підвищений негативний заряд. Позитивно заряджені ядра притягуються до неї (це відомо з курсу фізики) і утворюється молекула. Таким чином, хімічний зв'язок – результат дії електричних сил. Уявімо вищесказане у вигляді схеми:

Слід зазначити, що у основі освіти ковалентного зв'язку, як і і при виникненні іонної зв'язку, лежить взаємодія протилежних зарядів.
На закінчення розглянемо алгоритм міркувань, необхідні у тому, щоб записати схему освіти ковалентного зв'язку, наприклад для молекули азоту N 2 .
1. Азот – це елемент головної підгрупи V групи (VA групи). Його атоми мають п'ять електронів на зовнішньому рівні. Щоб визначити кількість неспарених електронів, скористаємося формулою:
8 - N = число неспарених електронів,
де N – номер групи хімічного елемента.
Отже, атоми азоту матимуть (8-5 = 3) три неспарені електрони.
2. Запишемо знаки хімічних елементів із позначенням зовнішніх електронів так, щоб неспарені електрони були звернені до сусіднього знаку:
![]()
3. Запишемо електронну та структурну формули молекули, що утворилася:
Якщо атоми пов'язані між собою однією загальною електронною парою, то такий ковалентний зв'язок називають одинарним, якщо двома - подвійним, якщо трьома - потрійним.
Чим більше загальних електронних пар у атомів у молекулі, тим міцніше вони пов'язані один з одним і тим менша відстань між ядрами атомів, яку називають довжиною зв'язку. У молекулах фтору зв'язок одинарний, і довжина зв'язку між ядрами атомів становить 0,14 нанометра (1 нм = 10 -9 м, або 0,000000001 м). У молекулах азоту зв'язок потрійний, і довжина його становить 0,11 нм. Щоб розділити молекулу азоту на окремі атоми, необхідно витратити приблизно сім разів більше енергіїніж для розриву одинарних зв'язків у молекулі фтору.
Ключові слова та словосполучення
- Атомний, або ковалентний, хімічний зв'язок.
- Одинарна, подвійна та потрійна ковалентні хімічні зв'язки.
- Довжина зв'язку.
- Електронні та структурні формули.
Робота з комп'ютером
- Зверніться до електронної програми. Вивчіть матеріал уроку та виконайте запропоновані завдання.
- Знайдіть в Інтернеті електронні адреси, які можуть бути додатковими джерелами, які розкривають зміст ключових слів і словосполучень параграфа. Запропонуйте вчителю свою допомогу у підготовці нового уроку - зробіть повідомлення за ключовими словами та словосполученнями наступного параграфа.
Запитання та завдання
- Усі елементи головної підгрупи VII групи (VIIA групи) Періодичної системи Д. І. Менделєєва (підгрупи фтору) утворюють прості речовини, що складаються з двоатомних молекул. Запишіть електронну схему освіти та структурну формулу таких молекул, використовуючи загальний хімічний знак для всієї підгрупи Г (галоген).
- Запишіть схеми утворення хімічних зв'язків речовин, склад яких відображають формулами КС1 і С1 2 .
- Скільки неспарених електронів мають атоми сірки? Який зв'язок буде в молекулах S2? Запишіть схему утворення хімічного зв'язку в молекулах S2.
- Розташуйте у порядку збільшення міцності хімічного зв'язку речовини з формулами S 2 , Cl 2 , N 2 та обґрунтуйте правильність свого рішення. Як змінюватиметься довжина зв'язку в молекулах складеного вами ряду?
- Розділіть речовини на дві групи за типом хімічного зв'язку: N2, Li2О, КС1, О2, CaF2, Н2.
Тема: Ковалентний неполярний зв'язок
Завдання:
Сформувати уявлення про ковалентний зв'язок, зокрема ковалентний неполярний зв'язок;
Показати механізм утворення ковалентного неполярного зв'язку;
Продовжити розвиток умінь аналізувати, робити висновки;
Виховувати культуру спілкування.
Мотивація та цілепокладання:
Чому азот чи водень існує у вигляді двоатомних молекул? У процесі розмови здійснюємо спільне цілепокладання та визначаємо тему уроку.
Вивчення нового матеріалу:
Давайте розглянемо, як утворюється хімічний зв'язок у молекуліCl 2.
Атом хлору знаходиться вVIIAгрупі Періодичної системи, отже, у нього сім електронів на зовнішньому енергетичному рівні і йому не вистачає лише одного електрона для його завершення. Шість електронів зовнішнього рівня утворюють пари, а один неспарений. Два атоми хлору, які мають по одному неспареному електрону, зближуються, ці електрони «об'єднуються» і стають загальними обох атомів, рівень у своїй стає завершеним – восьми електронним. Загальну пару електронів можна позначити просто рисою.
Тому ковалентний зв'язок, або атомний - це хімічний зв'язок, що виникає в результаті утворення загальних електронних пар.
Цей хімічний зв'язок утворюється між атомами одного і того ж неметалу, при цьому загальні електронні пари, які утворилися, належать обом атомам рівною мірою і на жодному з них не буде ні надлишку, ні нестачі негативного заряду, тому цей ковалентний зв'язок називається неполярним.
Аналогічно утворюється і молекула Н 2. Однак атом водню знаходиться вIAгрупі, тому кожен атом водню має лише один електрон і до завершення зовнішнього енергетичного рівняйому не вистачає всього одного електрона (нагадаю, що для атомів водню та гелію рівень вважається завершеним, якщо на ньому 2 електрони). Кожен атом водню має по одному електрону і ці неспарені електрони об'єднуються, утворюючи загальну електронну пару, яку можна позначити як рисочки.
Крім того, при зближенні двох атомів водню, кожен з яких має по одній s-електронній хмарі сферичної форми, відбувається перекриття цих електронних хмар. При цьому утворюється область, де щільність негативного заряду велика, позитивно заряджені ядра притягуються до неї і утворюється молекула.

Давайте розглянемо механізм утворення більш складної молекули 2 .
Кисень знаходиться вVIAгрупі, отже, він має 6 електронів на зовнішньому рівні. А щоб визначити число неспарених електронів, можна використовувати формулу 8 –N, деN- Номер групи. Тому в кожного атома кисню буде по 2 неспарені електрони, які братимуть участь в утворенні хімічного зв'язку. Ці два неспарені електрони поєднуються з двома іншими неспареними електронами іншого атома і утворюється дві загальні електронні пари, що умовно можна зобразити у вигляді двох рис.
Оскільки зв'язок у молекулі кисню складається з двох електронних пар, її називають ще подвійною, вона буде більш міцною, ніж одинарна, як у молекулі водню. Але треба розуміти, чим міцніший зв'язок між атомами в молекулі, тим менша відстань між ядрами атомів. Ця відстань називається довжиною зв'язку. Потрійний зв'язок ще коротший за подвійний, але набагато міцніший. Наприклад, в молекулі азоту потрійний зв'язок, щоб розділити молекулу на два атома необхідно витратити в сім разів більше енергії, ніж для розриву одинарного зв'язку в молекулі хлору.
Узагальнення та систематизація знань:
Який хімічний зв'язок називається ковалентним?
Між атомами яких елементів утворюється ковалентний неполярний зв'язок?
У чому суть утворення ковалентного зв'язку?
Чим одинарний зв'язок відрізняється від подвійного та потрійного?
Що показує довжина зв'язку і чого вона залежить?
Закріплення та контроль знань:
Складіть схеми утворення молекул речовин: а) брому; б) фтору; в) азоту.
Виключіть зайве з кожного ряду:
а) CO 2 , NH 3 , P 4 , P 2 O 5 ;
б) Cl 2 , S, N 2 , CO 2 .
Відповідь:
а)P 4 ; б)Cl 2 , S, N 2 . Це речовини з ковалентним неполярним зв'язком.
Виберіть речовини з ковалентним неполярним зв'язком:
P 4 , H 2 S, NH 3 , P 2 O 3 , S, N 2 , O 2 , H 2 O, HCl, H 2 .
Відповідь: речовини з ковалентним неполярним зв'язком утворені однаковими атомами неметалів, тому це будутьP 4 , S, N 2 , O 2 , H 2 .
Рефлексія та підбиття підсумків:
Як ви вважаєте, як засвоєно матеріал уроку? а) добре; б) добре; в) задовільно; г) не засвоєно.
Чи можете ви зараз відповісти на запитання, яке ми ставили на початку уроку?
Домашнє завдання:
Iрівень: §11, упр. 1 – 3;
IIрівень: теж + упр. 4, 5.